
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
(1)B,C,D中第一电离最大的元素其基态原子有种不同能量的电子.
(2)G分子中D原子的杂化方式为 , F2+的基态价电子排布式为 .
(3)BA3﹣离子的空间构型为 , 与其互为等电子体的一种阳离子的电子式为 .
(4)某化合物晶胞结构如图所示,E2+的配位数是 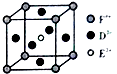
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2水溶液反应的离子方程式;该阳离子还能与H分子作用生成羟基,经测定此时的H具有酸性,写出该过程的离子方程式 .
【答案】
(1)3
(2)sp3;3d2
(3)三角锥形;![]()
(4)6
(5)水分子间存在氢键;2H2O++SO2=4H++SO42﹣;H2O++H2O=﹣OH+H3O+
【解析】解:A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,中的A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2 , 故B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca;F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,则F为Ti.(1)C、N、O中第一电离最大的元素为N元素,其基态原子核外电子排布式为1s22s22p3 , 有3种不同能量的电子,所以答案是:3;(2)G为H2O2 , O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为sp3 , O原子杂化方式为sp3 , Ti2+的基态价电子排布式为3d2 ,
所以答案是:sp3;3d2;(3)CH3﹣离子中C原子孤电子对数= ![]() 1,价层电子对数=3+1=4,故离子的空间构型为三角锥形,与其互为等电子体的一种阳离子为H3O+ , 电子式为
1,价层电子对数=3+1=4,故离子的空间构型为三角锥形,与其互为等电子体的一种阳离子为H3O+ , 电子式为 ![]() ,
,
所以答案是:三角锥形; ![]() ;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2﹣离子相邻,E2+配位数是6,
;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2﹣离子相邻,E2+配位数是6,
所以答案是:6;(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+ .
①水分子间能形成“网”的原因是:水分子间存在氢键,
所以答案是:水分子间存在氢键;
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O++SO2=4H++SO42﹣ , 该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,该过程的离子方程式为H2O++H2O=﹣OH+H3O+ ,
所以答案是:2H2O++SO2=4H++SO42﹣;H2O++H2O=﹣OH+H3O+ .


科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500molL﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000molL﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( ) 
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣)
B.点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
D.滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中水只表现还原性的是
A. 3NO2+H2O=2HNO3+NO
B. 2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
C. 2F2+2H2O=4HF+O2
D. 2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱盐的说法正确的是( )
A. 化合物电离时,生成的阳离子有氢离子的是酸
B. 化合物电离时,生成的阴离子有氢氧根的是碱
C. 化合物电离时,只有生成金属阳离子与酸根离子的才是盐
D. 盐酸、稀硫酸、浓硝酸都能导电,但它们既不是电解质也不是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
(1)属于盐的是________(填序号),写出这种物质在水溶液中的电离方程式__________。
(2)上述物质中有一种与其他三种物质均能反应,此物质是_________(填序号)。
(3)写出铝与稀硫酸反应的离子方程式,并用双线桥标出电子转移情况________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,生成2体积气体化合物Z,则Z的化学式可能是( )
A.X2Y3B.XYC.X3YD.XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《华北电力大学学报:社会科学版》2014年第2期的文章《欧盟暂停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放税的背景人手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对于环境保护、技术革新和国际法的促进作用.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+KMnO4+H2SO4=CO2↑+MnSO4+K2SO4+H2O
(2)在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
n/mol | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
上述反应T1℃时的平衡常数为K1 , T2℃时的平衡常数为K2 .
①计算:K1=
②根据上述信息判断,温度T1和T2的关系是(填序号) .
A. T1>T2 B. T1<T2 C.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)CO2(g)+H2(g);△H=﹣41kJ/mol
已知:2H2O (g)═2H2(g)+O2(g);△H=+484kJ/mol,
①写出CO完全燃烧生成CO2的热化学方程式: .
②某温度下,在一容积可变的容器中,CO转化生成CO2的反应达到平衡时,CO、O2和CO2的物质的量分别为4mol、2mol、和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:(填序号) .
A. 均增加1mol B. 均加倍 C. 均减少1mol D. 均减半.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请把符合要求的化学方程式的字母填在下列空白处:
A.(NH4)2SO3 ![]() 2NH3↑+H2O+SO2↑
2NH3↑+H2O+SO2↑
B.2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
C.2C+SiO2 ![]() Si+2CO↑
Si+2CO↑
D.NH4NO3 ![]() N2O↑+2H2O
N2O↑+2H2O
E.Na2CO3+CO2+H2O═2NaHCO3
F.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①既属于分解反应又是氧化还原反应的是
②属于分解反应,但不是氧化还原反应的是
③属于化合反应,但不是氧化还原反应的是
④不属于四种基本反应类型的氧化还原反应的是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com