
【题目】《华北电力大学学报:社会科学版》2014年第2期的文章《欧盟暂停征收航空碳排放税的法律思考》,该文章从欧盟暂停征收航空碳排放税的背景人手,分析了欧盟征收航空碳排放税的争议焦点所在,最后对欧盟暂停征收航空碳排放税进行了评析,并提出征收航空碳排放税是未来趋势的观点,希望在反对声中换一个视角来阐述征收航空碳排放税对于环境保护、技术革新和国际法的促进作用.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+KMnO4+H2SO4=CO2↑+MnSO4+K2SO4+H2O
(2)在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如表:
n/mol | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
上述反应T1℃时的平衡常数为K1 , T2℃时的平衡常数为K2 .
①计算:K1=
②根据上述信息判断,温度T1和T2的关系是(填序号) .
A. T1>T2 B. T1<T2 C.无法比较
(3)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)CO2(g)+H2(g);△H=﹣41kJ/mol
已知:2H2O (g)═2H2(g)+O2(g);△H=+484kJ/mol,
①写出CO完全燃烧生成CO2的热化学方程式: .
②某温度下,在一容积可变的容器中,CO转化生成CO2的反应达到平衡时,CO、O2和CO2的物质的量分别为4mol、2mol、和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是:(填序号) .
A. 均增加1mol B. 均加倍 C. 均减少1mol D. 均减半.
【答案】
(1)5;4;6;5;4;2;6
(2)![]() ;C
;C
(3)2CO(g)+O2(g)═2CO2(g)△H=﹣566 kJ/mol;A
【解析】解:(1)反应中C→CO2 , 碳元素化合价由0价升高为+4价,共升高4价,KMnO4→MnSO4 , Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为20,故C的系数为5,故KMnO4系数为4,结合原子守恒配平后方程式为:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O,
所以答案是:5、4、6、5、4、2、6;
(2.)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2 , 且该反应为可逆反应,故反应方程式为:C+2NON2+CO2 .
①平衡时c(NO)= ![]() =0.02mol/L,c(N2)=c(CO2)=
=0.02mol/L,c(N2)=c(CO2)= ![]() =0.015mol/L,故T1℃时该反应的平衡常数为K1=
=0.015mol/L,故T1℃时该反应的平衡常数为K1= ![]() =
= ![]() =
= ![]() ,
,
所以答案是: ![]() ;
;
②由表中数据可知,温度由T1变为T2 , 平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,
所以答案是:C;
(3.)①已知:Ⅰ.CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ/mol
Ⅱ.2H2O (g)═2H2(g)+O2(g)△H=+484kJ/mol,
根据盖斯定律,Ⅰ×2﹣Ⅱ可得:2CO(g)+O2(g)═2CO2(g)△H=﹣566 kJ/mol
所以答案是:2CO(g)+O2(g)═2CO2(g)△H=﹣566 kJ/mol;
②平衡时CO、O2和CO2的物质的量分别为4mol、2mol、和4mol,保持温度和压强不变,则三种物质的量之比为2:1:2时处于平衡状态.
A.CO、O2和CO2的物质的量分别为5mol、2.5mol、5mol时处于平衡状态,均增加1mol等效为前者平衡的基础上增大0.5molO2 , 平衡正向移动,故A正确;
B.物质的量均加倍 CO、O2和CO2的浓度之比与原平衡相同均2:1:2,平衡不移动,故B错误;
C.CO、O2和CO2的物质的量分别为3mol、1.5mol、3mol时处于平衡状态,均减少1mol等效为前者平衡的基础上移走0.5molO2 , 平衡逆向移动,故C错误;
D.物质的量均减半,CO、O2和CO2的浓度之比与原平衡相同均2:1:2,平衡不移动,故D错误,
所以答案是:A.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
(1)B,C,D中第一电离最大的元素其基态原子有种不同能量的电子.
(2)G分子中D原子的杂化方式为 , F2+的基态价电子排布式为 .
(3)BA3﹣离子的空间构型为 , 与其互为等电子体的一种阳离子的电子式为 .
(4)某化合物晶胞结构如图所示,E2+的配位数是 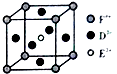
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2水溶液反应的离子方程式;该阳离子还能与H分子作用生成羟基,经测定此时的H具有酸性,写出该过程的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列溶液做导电实验,其中灯泡最亮的是 ( )
A. 1mol/L 的NaCl溶液 B. 75%的乙醇溶液
C. 90%的蔗糖溶液 D. 1mol/L 的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间的反应中,不属于离子反应的是( )
A. Zn和H2SO4(稀)反应
B. NaCl溶液和AgNO3溶液反应
C. C和O2反应
D. Fe和CuSO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的常见单质或化合物,金属单质A在常温下可以和氧气生成化合物C,且A可以和氢氧化钠溶液反应。化合物E淡黄色物质,可用于呼吸面具,可由一种活泼金属D在氧气中燃烧得到。单质B是所含元素在地壳中含量居于第四。回答问题:
(1)物质E的化学式___________,E与水反应的离子方程式____________________。
(2)单质A与NaOH反应的离子方程式_______________________,化合物C与硫酸反应的离子方程式:_______________________________。
(3)单质B与水蒸汽反应的化学方程式为___________________________________。
(4)单质D与CuSO4溶液反应的化学方程式为__________________________。
(5)活泼金属D与水的反应中,做___________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com