
【题目】中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是 (填字母)。
(2)下列操作合理的是 (填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaOH溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
Ⅱ. 某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是 ___(填编号)。
(2)判断滴定终点的现象是: 。
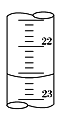
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据,请计算待测盐酸的浓度: mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 (填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
【答案】
Ⅰ.(1)ab(2分)(2)AD(1分)
Ⅱ.(1)①(2分)
(2)滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色(2分)
(3)22.60(1分)
(4)0.2000(2分)
(5)ACD(2分)
【解析】
试题分析:
Ⅰ.(1)量筒和容量瓶没有“0”刻度,故无“0”刻度的是ab;
(2)托盘天平精确度为0.1g,不能精确称量10.20克碳酸钠固体;用100mL的量筒量取3.2mL浓硫酸造成的误差较大,应该用10mL的量筒量取,故B、C错误,A、D操作合理;
Ⅱ.(1)根据碱式滴定管在装液前应该用待装液进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入氢氧化钠溶液到0刻度以上,碱式滴定管未用标准氢氧化钠溶液润洗就直接注入标准氢氧化钠溶液,标准液的浓度偏小,造成标准液的体积偏大,根据计算公式分析,待测溶液的浓度偏大。
(2)中和滴定中,眼睛应该注视的是锥形瓶中颜色的变化,滴定时,当溶液中颜色变化且半分钟内不变色,可以说明达到了滴定终点,所以当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色。
(3)滴定管精确度为0.01mL,每一格表示1mL,图中读数为22.60mL。
(4)第一次和第三次消耗氢氧化钠溶液体积20.00mL,第二次消耗氢氧化钠溶液体积22.10mL,第二次数据应舍去。氢氧化钠溶液体积为20.00mL,氢氧化钠溶液浓度为0.2000mol·L-1,盐酸体积为20.00mL,由n(HCl)=n(NaOH)得盐酸浓度为0.2000 mol·L-1。
(5)A.配制标准溶液的固体NaOH中混有KOH杂质,导致标准氢氧化钠溶液的浓度偏小,则需要氢氧化钠溶液的集体偏大,所测的盐酸浓度偏大;B.滴定结束时,俯视读数,所用的氢氧化钠溶液体积偏小,所测的盐酸的浓度偏小;C.锥形瓶用待测液润洗,待测液的物质的量增大,所用的氢氧化钠的体积偏大,所测的盐酸浓度偏大;D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,所用的氢氧化钠的体积偏大,所测的盐酸浓度偏大;故选ACD。


科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)分子中两个共价键的夹角接近90°,其原因是( )
①共价键的饱和性②S原子的电子排布③共价键的方向性④S原子中p轨道的形状
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,雾霾又上了度娘热搜榜。其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成空气中存在的两种无毒物质。
①写出该反应的化学反应方程式:_____________。
②已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.28kJ mol-1;
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2= -1269.02kJ mol-1。105℃时,则上述脱硝反应的△H=_______,该反应________(填“能” “否”或“不能确定”)自发进行,
③上述脱硝反应中氧化剂和还原剂的物质的量之比为________。每生成1mol还原产物,则反应中转移电子数为_________mol。
(2)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如下表及图所示,回答下列问题:
容器 | 甲 | 乙 |
容积/L | 1 | 1 |
温度/K | T1 | T2 |
起始充入量 | lmolO3 2mol NO2 | lmolO3 2mol NO2 |
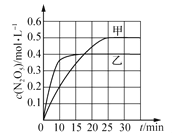
0~10min内甲容器中反应的平均速率:v(O3) =_______mol·L-1·min-1 。
②T1________T2 (填“>”“<”或“=”),T1时,该反应的平衡常数为____________。
③下列措施能提高容器乙中NO2转化率的是________(填序号)。
A.向容器中充入He,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的NO2
D.向容器中再充入lmol O3和2mo NO2
④T1时,若起始时向容器甲中充入2mo1 NO2、lmolO3、2mollN2O5和2molO2,则脱硝反应达到平衡前,v(正)________v(逆) (填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中。假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是:
A.过滤 B.萃取 C.蒸发 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(气)+3B(气)![]() 2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,B的体积分数减小
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。 ②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请写出:
(1)A元素的最高价氧化物的结构式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的离子方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证 明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
① Cl-的结构示意图![]()
② 羟基的电子式:![]()
③ HClO的结构式:H—Cl—O
④ NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤ Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥ SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦ 分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焓变是指1 mol物质参加反应时的能量变化
B. 当反应放热时ΔH>0,反应吸热时ΔH<0
C. 在加热条件下发生的反应均为吸热反应
D. 一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com