
����O3�dz�����������ʵ���ҿ��õ��ϡ�����Ʊ���װ����ͼ(��֪��Һ�зŵ�˳��O2��H��)������˵����ȷ���� (����)

A����C��ͨ��O2�����ʱ��Һ�е�������A����B��Ǩ��
B����C��ͨ��O2��A���ĵ缫��ӦʽΪ��2H����2e��===H2��
C����C����ͨ��O2�����Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ��3O2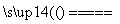 2O3
2O3
D����C����ͨ��O2��D��E���ֱ��ռ���x L��y L����(��״����)����E���ռ���y L������O3��ռ���������Ϊ (����O3�ķֽ�)
(����O3�ķֽ�)
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����еĻ���������Զ��ߺ��ֱ�����ϣ�ֻҪ�ܵ�����һ������ȫȼ��ʱ��������������Ϊ��ֵ��������������������һ����
A. ��ϩ������ B. ��ȩ�������� C. ��ϩ�ͻ����� D. ��Ȳ�ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й��л����˵������ȷ����
A�����е��л��ﶼ������ȼ��
B�����鲻��ʹ���������Һ��ɫ
C������ͬһͨʽ���л���һ����Ϊͬϵ��
D�����������͡��ƾ��������л��ܼ��е�����һ�����л���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ؽᾧ����������ܼ������ʵ��ܽ���٣����л�����ܽ��ԱȽ�ǿ����ôһ�ι��˺�
A���л�����Ȼ����Һ�� B����������Һ��
C���л���ͣ������ֽ�� D�����ʡ��л��ﶼͣ������ֽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ�����������ȷ���� (����)��
A����������Ľṹʽ��H��O��O��H
B��2,2���������ʵ��ʽ��C3H7
C������������������ȵ���ԭ�ӷ��ţ� H
H
D��Na2O2�ĵ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ͪ�Ǻϳ�ij�ֿ���ҩ����Ҫ�м��壬��ṹ����ͼ��ʾ�����й��ڰ�����ͪ�����ʵ���������ȷ���� (����)
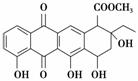
A��������ͪ�ķ���ʽΪC22H22O8
B�������к�������̼ԭ��
C������FeCl3��Һ������ɫ��Ӧ
D��1 mol������������5 mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ź㷺����;��������ڻ��ʡ��ϳ���ά�ȹ�ҵ����������ˮ��Һ�д��ڵ���ƽ�⣬���õ��볣��Kb�͵��������������ʾ�����̶ȡ�Kb�������õIJⶨ��������һ���¶�ʱ����ȼƲⶨһϵ�� ��֪Ũ�Ȱ�ˮ��pH���ɵø�Ũ�Ȱ�ˮ��Ӧ��c(OH��)��Ȼ��ͨ��������ø���Ӧ����ֵ��Kbֵ��������ij��ѧ��ѧ��ȤС����25 ��ʱ�ⶨһϵ��Ũ�Ȱ�ˮ
��֪Ũ�Ȱ�ˮ��pH���ɵø�Ũ�Ȱ�ˮ��Ӧ��c(OH��)��Ȼ��ͨ��������ø���Ӧ����ֵ��Kbֵ��������ij��ѧ��ѧ��ȤС����25 ��ʱ�ⶨһϵ��Ũ�Ȱ�ˮ ��pH����Ӧ��c(OH��)��
��pH����Ӧ��c(OH��)��
[�������Լ�]��ȼơ�50 mL��ʽ�ζ��ܡ�100 mL�ձ���0.10 mol��L��1��ˮ
[ʵ������](���������)
| �ձ��� | V��ˮ(mL) | Vˮ(mL) | c(NH3��H2O) (mol��L��1) | c(OH��) (mol��L��1) | Kb | �� |
| 1 | 50.00 | 0.00 | 1.34��10��3 | 1.34% | ||
| 2 | 25.00 | 25.00 | 9.48��10��4 | 1.90% | ||
| 3 | 5.00 | 45.00 | 4.24��10��4 | 4.24% |
�����������Ϣ�ش��������⣺
(1)25 ��ʱ����ˮ�ĵ��볣����Kb��________(������λ��Ч����)��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ________��
(2)��0.10 mol��L��1����ֱ�ζ�20.00 mL 0.10 mol��L��1��NaOH��Һ��20.00 mL
0.10 mol��L��1��ˮ���õĵζ��������� ����ָ������ζ���ˮ������Ϊ________(�A����B��)����д������a������Ӧ����Һ�и�����Ũ���ɴ�С������˳��________��
����ָ������ζ���ˮ������Ϊ________(�A����B��)����д������a������Ӧ����Һ�и�����Ũ���ɴ�С������˳��________��

(3)Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ����������صķ�Ӧ�У�
4NH3(g)��3O2(g)===2N2(g)��6H2O(l)����H1��
4NH3(g)��5O2(g)===4NO(g)��6H2O(l)����H2��
4NH3(g)��6NO(g)===5N2(g)��6H2O(l)����H3��
��д������������Ӧ�Ц�H1����H2����H3����֮���ϵ�ı���ʽ����H1��________��
(4)AllisChalmers���칫˾���ֿ����ð���Ϊȼ�ϵ�ص�ȼ�ϡ����ܷ�ӦʽΪ4NH3��3O2===2N2��6H2O�������ϵĵ缫��ӦʽΪO2��2H2O��4e��===4OH�������ϵĵ缫��ӦʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵĵݱ��У�����ȷ���� ( )
A��HCl��H2S��PH3���ȶ������μ���
B��HClO4��H2SO4��H3PO4��H4SiO4���������μ���(��ͬ������)
C��CsOH��KOH��LiOH�ļ������μ���
D��Na+��Mg2+��Al3+�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������Ӽ����й��ۼ�����λ���Ļ�������( )
A��NH4NO3 B��NaOH C��H2SO4 D��H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com