
科目:高中化学 来源: 题型:
臭氧O3是常用消毒剂,实验室可用电解稀硫酸制备,装置如图(已知溶液中放电顺序:O2>H+)。下列说法正确的是 ( )

A.若C处通入O2,电解时溶液中的质子由A极向B极迁移
B.若C处通入O2,A极的电极反应式为:2H++2e-===H2↑
C.若C处不通入O2,该制备过程总反应的化学方程式为:3O2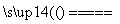 2O3
2O3
D.若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况下),则E处收集的y L气体中O3所占的体积分数为 (忽略O3的分解)
(忽略O3的分解)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| 族 周期 | I A | ⅡA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ |
| |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是 。
(2)①②⑤⑥⑧中,最高价氧化物的水化物中碱性最强的是 酸性最强的是
(3)②③④中形成的简单离子半径由大到小的顺序是 。⑧⑨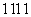 三种元素形成的气态氢化物最稳定的是 。
三种元素形成的气态氢化物最稳定的是 。
(4)元素①与⑦形成个数比l:1化合物的电子式为: ,该化合物灼烧时焰色 为 ,该化合物常温下和元素⑦的氢化物反应的离子方程式是 。
(5)写出单质⑤和元素①的最高价氧化物对应的水化物相互反应的化学方程式:
。
(6) ③和⑧两元素可形成 (填“离子键”或“共价键”),写出其形成过程:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组的几种分子或离子中所有原子都处于同一平面的是
A.C2H4、CS2、H2O、CO32- B.H2O2、BF3、CH3OH、ClO3-
C.C2H2、C6H6、CO2、 SO42- D.C2H6、C2F4、PH3、H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
Ti、Fe、Ni、Cu、Zn、La等过渡金属能形成配合物或化合物与这些金属原子的电子层结构有关。
(1)基态Ni原子的外围电子排布式为 。
(2)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。其中Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。CO与N2 互为等电子体,与CO互为等电子体的离子为 (任写一种);
(3)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。试推断绿色晶体的化学式为 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图1所示,其晶胞边长为540.0 pm,则a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。


图1 图2
(6)镧镍合金有很强储氢能力,已知镧镍合金LaNin晶胞如图2,晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),氢在合金中的密度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
列电子构型的原子中,第二电离能与第一电离能差值最大的是( )
A.1s22s22p5 B.1s22s22p6
C.1s22s22p63s1 D.1s22s22p63s2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
请填写下列物质的结晶方法。
(1)氯化钠:______________;(2)硝酸钾:______________;
(3)硫酸铜晶体:______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com