
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
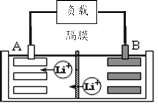
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
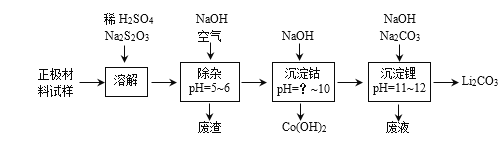
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。
【答案】正 LixC6 —xe—=6C + xLi+ 8LiCoO2 + Na2S2O3 +11H2SO4=4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O 确保在pH=5~6时将铁元素除尽,且不使Co2+沉淀 9.0
【解析】
(1)根据锂离子移动方向判断正负电极;
(2)①在上述溶解过程中,S2O32-被LiCoO2氧化成SO42-,LiCoO2被还原成Co2+;
②Fe2+在5~6时不能生成氢氧化物沉淀,Fe3+在5~6时完水解成氢氧化铁沉淀;
③根据Co2+开始沉淀的pH计算Co(OH)2的Ksp,再根据“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1计算氢氧根离子浓度,进而计算pH。
(1)原电池中,阳离子移向正极,根据图示,Li+移向A电极,所以A是正极、B是负极,原电池负极失电子发生氧化反应,B的电极反应式为LixC6 —xe—=6C + xLi+;
(2)①在上述溶解过程中,S2O32-被LiCoO2氧化成SO42-,LiCoO2被还原成Co2+,根据得失电子守恒配平方程式为8LiCoO2 + Na2S2O3 +11H2SO4=4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O;
②Fe2+在5~6时不能生成氢氧化物沉淀,Fe3+在5~6时完水解成氢氧化铁沉淀,通空气将Fe2+氧化为Fe3+的目的是确保在pH=5~6时将铁元素除尽,且不使Co2+沉淀;
③Co2+开始沉淀的pH为7,则Ksp[Co(OH)2]=![]() ,“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1,
,“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1,![]() ,
,![]() ,所以pH不低于9。
,所以pH不低于9。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】向100mL0.1molL-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1molL-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法正确的( )
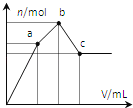
A.a点的溶液呈中性
B.a点沉淀的质量比c点沉淀的质量大
C.b点加入Ba(OH)2溶液的体积为250mL
D.至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3H2O+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物存在着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(g)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=___;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___;
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态。
①___;②___。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___。
a.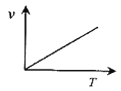 b.
b.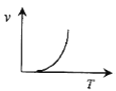
c.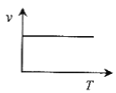 d.
d.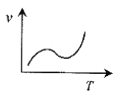
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___;欲使上述体系中Al3+浓度增加,可加入的物质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
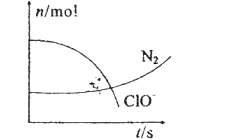
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2则转移电子1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________ g。
(2)钠—钾合金可在核反应堆中用作热交换液。5.05 g钠—钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。________
②计算并确定该钠-钾合金的化学式。______________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2―→2Al(OH)3↓+Na2CO3+H2O,己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答问题:
① | |||||||
② | |||||||
③ | ④ | ⑤ | |||||
⑥ |
(1)①和②形成的最简单化合物的结构式是__________,该分子的空间构型是________。
(2)⑤元素位于元素周期表 ___ ,最外层电子的排布式 _________ ,原子核外有 _______种能量不同的电子。CCl4 是一种常见的有机溶剂,判断其属于 _______ (填“极性”、“非极性”)共价键,_________ 分子(填“极性”、“非极性”)。
(3)某元素3P亚层上只有一个电子,判断其离子与②,⑤离子半径大小 ______ (用微粒符号表示),写出该元素单质与元素③最高价氧化物对应水合物反应的化学方程式:________。
(4)设计一个实验方法:比较⑤与⑥单质氧化性的强弱,填入下表。
实验步骤 | ________ |
实验现象 | ________ |
实验原理 | ________ |
实验结论 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.在不同油耗汽车中发生反应③,ΔH3会不同
C.植物的光合作用通过反应①将热能转化为化学能
D.反应④C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH4,则ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com