
已知短周期相邻三元素A、B、C.A与B同周期,B与C同主族,三元素质子数之和为33,则三元素在元素周期表中相对位置关系正确的是
[ ]
|
A. |
B A C |
B. |
A B C |
C. |
C B A |
D. |
A C B |
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
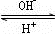 R(OH)3
R(OH)3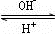 [R(OH)4]-
[R(OH)4]-查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z |
| 甲 | 乙 | 丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
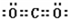
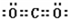
查看答案和解析>>
科目:高中化学 来源: 题型:
A.P、Si、C B.N、C、Si C.B、C、Si D.Al、Si、C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com