
分析 已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,则A是Ar,又知B、C和D是由两种元素的原子组成,所以B是HCl,C是H2S,四原子分子D为PH3或H2O2,以此解答该题.
解答 解:已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,则A是Ar,又知B、C和D是由两种元素的原子组成,所以B是HCl,C是H2S,四原子分子D为PH3或H2O2,
(1)由以上分析可知B为,C为,D为,故答案为:HCl; H2S;PH3或H2O2;
(2)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,说明E中含有碳氢元素,且碳氢个数比为1:4,E中含有6个原子,所以还含有一个氧原子,所以E的分子式为CH4O,
故答案为:CH4O.
点评 本题考查物质结构及性质,正确推断物质是解本题关键,为高频考点,侧重于学生的分析能力的能力的考查,注意把握与原子的结构特点以及对应物质的性质,应重点掌握,难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:实验题
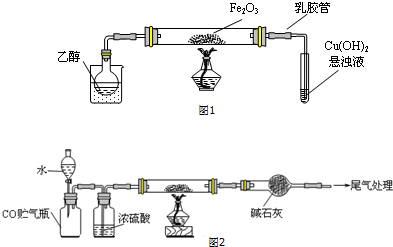
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 氯气与水的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:Al+OH-+6H2O=[Al(OH)4]-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
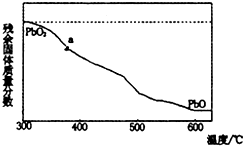 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是34 | B. | 最高价氧化物的化学式为SeO3 | ||
| C. | 金属性比较强 | D. | 气态氢化物的化学式为H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
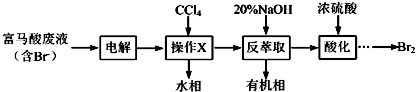
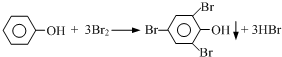
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
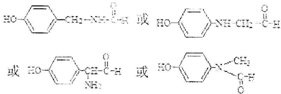
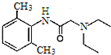 )是一种局部麻醉药物,可由下列路线合成:
)是一种局部麻醉药物,可由下列路线合成: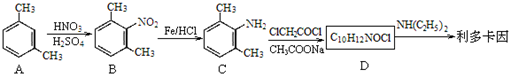
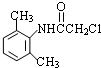 .
.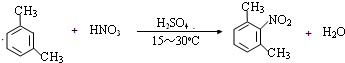 .
. .
.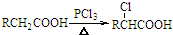 ,写出以苯和乙醇为原料制备
,写出以苯和乙醇为原料制备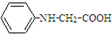 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,平衡向正反应方向移动 | |
| C. | 当进行4分钟时,反应已达平衡状态 | |
| D. | 其他条件不变,通过缩小容器体积增大压强,平衡常数减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com