
 盐在化学工业中有重要的应用,请回答下列问题
盐在化学工业中有重要的应用,请回答下列问题分析 (1)Fe3+离子水解生成具有较强吸附性的Fe(OH)3胶体,据此分析;
(2)常温下,在pH=3的硫酸溶液中水电离出的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{10-3}$=10-11,pH=11的Na2S溶液中水电离出的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体是硫离子和铝离子发生双水解反应生成硫化氢和氢氧化铝沉淀;
(3)物质的量浓度相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
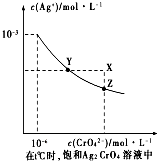
(4)A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
C、依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀;
D、已知t℃时AgCl的Ksp=2×10-10,由A 知Ag2CrO4的Ksp为1×10-12,则S(AgCl)=$\sqrt{Ksp}$=$\sqrt{2×1{0}^{-10}}$=1.41×10-5,而S(Ag2CrO4)=$\root{3}{\frac{Ksp}{4}}$=$\frac{\root{3}{2}}{2}$×10-4;
(5)当离子浓度小于1×10-5mol/L时,认为完全沉淀,Ksp[Fe(OH)3]=1×10-38,计算此时氢氧根离子浓度计算PH,沉淀完全,依据,Ksp[Cu(OH)2]=1×10-20,Cu2+为0.01mol•L-1 时计算氢氧根离子浓度得到溶液PH,此时铜离子未沉淀;
解答 解:(1)Fe3+离子水解生成具有较强吸附性的Fe(OH)3胶体,反应的离子方程式为:Fe3++3H2O?Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)常温下,在pH=3的硫酸溶液中水电离出的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{10-3}$=10-11,pH=11的Na2S溶液中水电离出的氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,水电离出来的c(OH-)之比=10-11:10-3=1:108,向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体是硫离子和铝离子发生双水解反应生成硫化氢和氢氧化铝沉淀,反应的离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,
故答案为:1:108;2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
(3)①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3H2O,
⑤NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),所以一水合氨溶液中铵根离子浓度最小;③中铵根离子系数是2,①②④中铵根离子系数都是1,所以③比①②④的大,②中氢离子抑制铵根离子水解,所以铵根离子难度②>①,④CH3COONH4 中醋酸根离子水解促进铵根离子水解,①>④所以NH4+浓度由大到小的顺序为:③>②>①>④>⑤,
故答案为::③>②>①>④>⑤;
(4)A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-,
Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,故A错误;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;
C、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=2.0×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=$\sqrt{\frac{1{0}^{-12}}{0.01}}$=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=$\frac{2×1{0}^{-10}}{0.01}$=2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
D、则S(AgCl)=$\sqrt{Ksp}$=$\sqrt{2×1{0}^{-10}}$=1.41×10-5,而S(Ag2CrO4)=$\root{3}{\frac{Ksp}{4}}$=$\frac{\root{3}{2}}{2}$×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,故D错误;
故答案为:C;
(5)当离子浓度小于1×10-5mol/L时,认为完全沉淀,Ksp[Fe(OH)3]=1×10-38,此时氢氧根离子浓度c(OH-)=$\root{3}{\frac{1×1{0}^{38}}{1{0}^{-5}}}$=10-11mol/L,氢离子浓度=10-3molL,计算PH=3,沉淀完全,依据Ksp[Cu(OH)2]=1×10-20,Cu2+为0.01mol•L-1 时计算氢氧根离子浓度c(OH-)=$\sqrt{\frac{1×1{0}^{-20}}{0.01}}$=10-9mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,得到溶液PH,此时铜离子未沉淀,溶液中PH应控制的范围是3~5,
故答案为:3~5;
点评 本题考查了盐类水解、溶液PH计算分析、沉淀溶解平衡的分析判断、溶度积常数的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用酒精可以提取某些花香中的酯类香精制成香水,利用了酯的某种化学性质 | |
| B. | 煤中含有苯、二甲苯等,可以通过煤的干馏得到,并将它们分离 | |
| C. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| D. | 在海轮外壳镶嵌锌块,能减缓轮船的腐蚀,是利用牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ③④⑤⑥ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将MgCl2溶液小心蒸干得到无水MgCl2 | |
| B. | 通过蒸馏分离苯和1,2-二溴乙烷 | |
| C. | 电解AlCl3溶液可以得到金属铝 | |
| D. | 通过过滤从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物光合作用:光能一生物质能 | B. | 电灯发光:电能-化学能 | ||
| C. | 木柴烧饭:生物质能一热能 | D. | 太阳能热水器:光能一热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 26g乙炔所含共用电子对数目为3 NA | |
| B. | 标准状况下,11.2L的新戊烷所含的分子数为0.5 NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA | |
| D. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com