
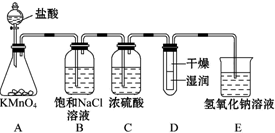
分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)分析元素中化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理;
(4)氯气不具有漂白性,次氯酸具有漂白性;
(5)依据氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸结合硫酸和盐酸无漂白性解答;
(6)配制450mL溶液,应选择500ml容量瓶,依据m=CVM计算需要氢氧化钠的质量.
解答 解:(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
故答案为:分液漏斗上端活塞未打开;
(2)反应中高锰酸钾中+7价锰降为氯化锰中+2价,高锰酸钾做氧化剂,氯化氢中-1价氯部分升高为氯气中0价,氯化氢做还原剂,依据得失电子守恒,则氯气系数为5,高锰酸钾系数为2,依据原子个数守恒,反应方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8 H2O;反应中消耗2mol高锰酸钾,则有10mol氯化氢被氧化,所以氧化剂和还原剂的物质的量之比为1:5;
故答案为:2;16;2;2;5;8; 1:5;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用装有氢氧化钠溶液的E吸收过量的氯气;
故答案为:吸收Cl2中的HCl;吸收Cl2中的H2O;吸收尾气,防止污染空气;
(4)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以看到干燥的布条不褪色,湿润的布条褪色;
故答案为:干布条不褪色,湿布条褪色;
(5)氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸,化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl,盐酸和硫酸不具有漂白性,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(6)配制450mL溶液,应选择500mL容量瓶,需称量的NaOH的质量=0.4mol•L-1×0.5L×40g/mol=8.0g,
故答案为:500 mL容量瓶;8.0 g.
点评 本题考查了氯气的实验室制备和性质的检验,一定物质的量浓度溶液的配制,明确氯气的制备原理和性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、K+、NO3-、Cl- | B. | Na+、K+、Cl-、OH- | ||
| C. | H+、Ba2+、CO32-、SO42- | D. | Na+、K+、OH-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 100 mL 1.5 mol•L-1FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
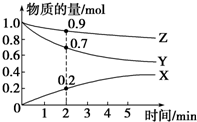 某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化学方程式为3Y+Z?2X;从反应开始至2min时,Z的反应速率为0.025mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.由此分析,该反应的化学方程式为3Y+Z?2X;从反应开始至2min时,Z的反应速率为0.025mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,可能有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Na+ | Al3+ | Cl- | X |
| 个数 | 2a | a | a | b |
| A. | NO3-、2a | B. | SO42-、2a | C. | OH-、2a | D. | SO42-、4a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com