
 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示,回答下列问题:
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示,回答下列问题:

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、青铜(锡铜合金)中的锡可对铜起保护作用 |
| B、在海轮外壳上焊接上锌块,可减缓船体的腐蚀速率 |
| C、海水中钢闸门与电源的正极相连,可以防止闸门的腐蚀 |
| D、钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1氯化钠溶液 |
| B、75 mL 1 mol?L-1氯化镁溶液 |
| C、150 mL 3 mol?L-1氯化钾溶液 |
| D、50 mL 3 mol?L-1氯化钙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,pH=7的醋酸和醋酸钠的混合溶液中,c(CH3COO-)=c(Na+) |
| B、pH相同的NH4Cl溶液和硫酸溶液,稀释相同倍数后,硫酸溶液的pH小 |
| C、Ba(NO3)2溶液可以鉴别SO2气体和CO2气体 |
| D、向足量饱和石灰水中加入0.56 g CaO,可析出0.74 g Ca(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入可溶性硅酸盐中析出硅酸沉淀,所以碳酸的酸性强于硅酸 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、铝比铁活泼,所以铝比铁更容易被腐蚀 |
| D、正常雨水pH等于7,酸雨的PH小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
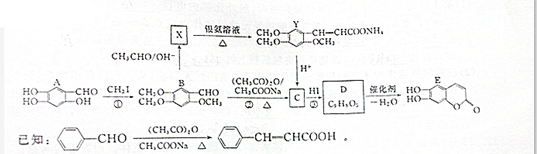
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(Ac-)+c(Cl-) |
| B、c(Na+)=c(Cl-)>c(H+)>c(Ac-)>c(OH-) |
| C、c (H+)>c(Cl-)>c(Na+)>c(Ac-)>c(OH-) |
| D、c(Na+)>c (H+)>c(Cl-)>c(Ac-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
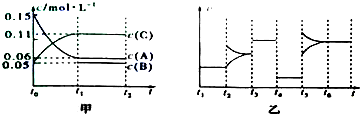
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com