
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
![]()
(2)反应中,被还原的元素是_________,还原剂是____________。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为_____________。
(1)Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
(2)![]() Na2S2O3
Na2S2O3
(3)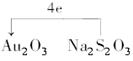
(4)1∶4
解析:(1)这是一个氧化还原反应,所以应按照“强氧化剂+强还原剂![]() 弱氧化剂+弱还原剂”的原理来完成化学方程式。Au2O3与Au2O相比,Au是高价(+3),Au2O3是氧化剂,所以与之相反应的就是还原剂——含低价元素。Na2S2O3与Na2S4O6相比,S是低价(+2),所以,Na2S2O3是还原剂,S元素被氧化,金元素被还原,基本反应为:Au2O3+Na2S2O3
弱氧化剂+弱还原剂”的原理来完成化学方程式。Au2O3与Au2O相比,Au是高价(+3),Au2O3是氧化剂,所以与之相反应的就是还原剂——含低价元素。Na2S2O3与Na2S4O6相比,S是低价(+2),所以,Na2S2O3是还原剂,S元素被氧化,金元素被还原,基本反应为:Au2O3+Na2S2O3![]() Au2O+Na2S4O6。对比反应前后:氧原子在反应后减少,钠离子相对硫原子也减少。所以要补充如下:生成物中要补钠——NaOH,相应的反应物中要补氢——H2O。补完后查对——各种原子守恒——反应原理正确。
Au2O+Na2S4O6。对比反应前后:氧原子在反应后减少,钠离子相对硫原子也减少。所以要补充如下:生成物中要补钠——NaOH,相应的反应物中要补氢——H2O。补完后查对——各种原子守恒——反应原理正确。
(4)氧化还原反应遵循得失电子守恒,Na2S2O3![]() 2H2SO4,Cl2
2H2SO4,Cl2![]() HCl,所以还原剂与氧化剂的物质的量之比为1∶4。
HCl,所以还原剂与氧化剂的物质的量之比为1∶4。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com