
A、用惰性电极电解熔融氯化钠:2Cl-+2H2O
| ||||
| B、用稀硫酸溶液除去铜表面的氧化铜:CuO+2H+=Cu2++H2O | ||||
| C、常温下,用稀氢氧化钠溶液吸收多余的氯气:Cl2+OH-=Cl-+ClO-+H2O | ||||
| D、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+CO32- |
| ||


科目:高中化学 来源: 题型:
| A、氧化铝与稀盐酸反应:Al2O3+6H+=2Al3++3H2O |
| B、氯化铵溶液与氢氧化钠溶液共热:NH4++OH-═NH3?H2O |
| C、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| D、硫酸亚铁溶液中加双氧水:Fe2++2H2O2+4 H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
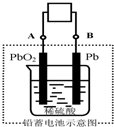 电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、M与T形成的化合物具有两性 |
| C、气态氢化物的稳定性为H2T<H2R |
| D、L和M金属性强弱比较:L>M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | ≥3~4 |
A、混合溶液中:c(SO
| ||
| B、若向混合溶液中加入铁粉,不可能观察到红色固体析出 | ||
| C、若向混合溶液中加入足量氯水,调节pH到3-4后过滤,得到纯净的CuSO4溶液 | ||
| D、若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用两个铜电极电解饱和食盐水:2Cl-+2H2O
| ||||
| B、AgCl悬浊液中加入硫化钠饱和溶液:2AgCl+S2-=Ag2S+2Cl- | ||||
| C、氢氧化镁与稀硫酸反应:H++OH-=H2O | ||||
D、向20mL沸水中滴入1mL饱和FeCl3溶液,继续煮沸至溶液呈红褐色:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、②⑤ | B、③⑤ |
| C、②③④ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com