
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
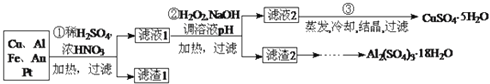
回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
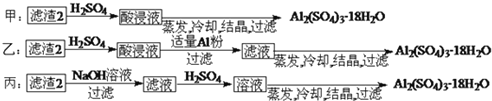
上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
【答案】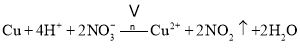 Au、Pt 把
Au、Pt 把![]() 氧化为
氧化为![]() 不引入杂质,产物对环境无污染
不引入杂质,产物对环境无污染 ![]() 、
、![]() 甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质
甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质 ![]()
【解析】
金属的混合物与稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO45H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。
![]() 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成
稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成![]() 、
、![]() 、
、![]() ;所以滤渣1的成分是Pt和Au,滤液1中的离子是
;所以滤渣1的成分是Pt和Au,滤液1中的离子是![]() 、
、![]() 、
、![]() ;第
;第![]() 步Cu与酸反应的离子方程式为:
步Cu与酸反应的离子方程式为: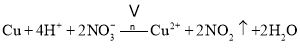 ,Au、Pt和酸不反应,所以是滤渣;
,Au、Pt和酸不反应,所以是滤渣;
故答案为: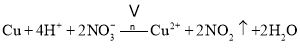 ,Au、Pt;
,Au、Pt;
![]() 第
第![]() 步加
步加![]() 的作用是将
的作用是将![]() 氧化为
氧化为![]() ,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将
,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将![]() 氧化为
氧化为![]() ,不引入杂质,产物对环境无污染,
,不引入杂质,产物对环境无污染,![]() 、
、![]() 生成沉淀;
生成沉淀;
![]() 制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
![]() 取
取![]() 试样配成100mL溶液,每次取
试样配成100mL溶液,每次取![]() ,消除干扰离子后,用
,消除干扰离子后,用![]() 标准溶液滴定至终点,平均消耗EDTA溶液
标准溶液滴定至终点,平均消耗EDTA溶液![]() 滴定反应如下:
滴定反应如下:![]() 铜离子物质的量和标准液物质的量相同
铜离子物质的量和标准液物质的量相同![]() ;依据元素守恒得到:
;依据元素守恒得到:
则20ml溶液中含有的![]() 物质的量为
物质的量为![]() ;100ml溶液中含
;100ml溶液中含![]() ;
;
所以![]() 质量分数的表达式
质量分数的表达式![]() ;故答案为:
;故答案为:![]() .
.


科目:高中化学 来源: 题型:
【题目】化合物H[3—亚甲基异苯并呋喃—1(3H)—酮]常被用来合成药物。它的一种合成路线如图:
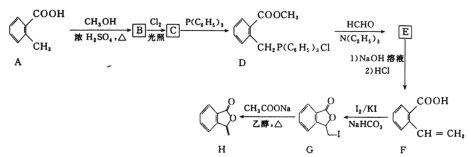
已知: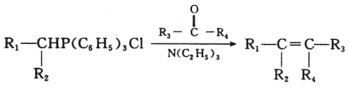 其中R1、R2、R3、R4为烃基或氢原子
其中R1、R2、R3、R4为烃基或氢原子
回答下列问题:
(1)C中所含官能团的名称是___。
(2)E的结构简式是___,G→H的反应类型是___。
(3)G与NaOH溶液反应的化学方程式是__。
(4)F的同分异构中符合下列条件的共有__种(不考虑立体异构)。
①能够与氯化铁溶液发生显色反应;
②能够与新制氢氧化铜浊液反应生成红色沉淀;
③分子中除苯环外无其他环状结构。
其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是__。
(5)写出以![]() 、P(C6H5)3、N(C2H5)3和丙酮(
、P(C6H5)3、N(C2H5)3和丙酮(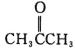 )为原料制备
)为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1) 写出As的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3) Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
(4) 砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
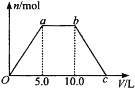
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯可被臭氧分解,发生化学反应![]() ,二甲苯通过上述反应可能的产物为
,二甲苯通过上述反应可能的产物为![]() ,若邻二甲苯进行上述反应,对其反应产物描述正确的是
,若邻二甲苯进行上述反应,对其反应产物描述正确的是
A. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶3
B. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶1
C. 产物为a和c,其分子个数比为a∶c=1∶2
D. 产物为b和c,其分子个数比为b∶c=2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
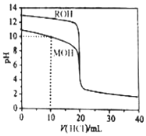
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种微粒:
①A微粒核内有12个中子,核外M电子层上有1个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有2个单位的正电荷,核电荷数为12;
④D微粒核外有18个电子,当失去2个电子时呈电中性;
⑤E微粒不带电,其质量数为1.
(1)请写出各微粒的符号:A_____________、B_____________、C_____________、D_____________、E_____________;
(2)A、D两元素形成的化合物属于_____________晶体,电子式_____________,
(3)B、E两种元素的原子之间可以通过_____________(填化学键的名称)形成化合物的化学式有_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com