
【题目】化合物H[3—亚甲基异苯并呋喃—1(3H)—酮]常被用来合成药物。它的一种合成路线如图:
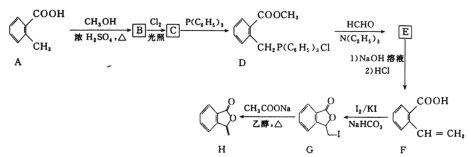
已知: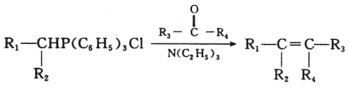 其中R1、R2、R3、R4为烃基或氢原子
其中R1、R2、R3、R4为烃基或氢原子
回答下列问题:
(1)C中所含官能团的名称是___。
(2)E的结构简式是___,G→H的反应类型是___。
(3)G与NaOH溶液反应的化学方程式是__。
(4)F的同分异构中符合下列条件的共有__种(不考虑立体异构)。
①能够与氯化铁溶液发生显色反应;
②能够与新制氢氧化铜浊液反应生成红色沉淀;
③分子中除苯环外无其他环状结构。
其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是__。
(5)写出以![]() 、P(C6H5)3、N(C2H5)3和丙酮(
、P(C6H5)3、N(C2H5)3和丙酮( )为原料制备
)为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
【答案】酯基、氯原子  消去反应
消去反应 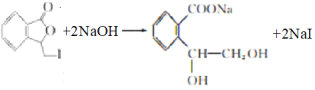 16
16 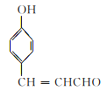
【解析】
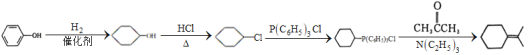
A和甲醇发生酯化反应生成B,B和氯气发生取代反应生成C(![]() ),
),![]() 和P(C6H5)3反应生成D,D和甲醛发生类似信息的反应得到E(
和P(C6H5)3反应生成D,D和甲醛发生类似信息的反应得到E( ),
), 再酸化得到F,F发生反应生成G,G发生消去反应得到H。
再酸化得到F,F发生反应生成G,G发生消去反应得到H。
⑴根据C的结构![]() 得到C中所含官能团的名称是酯基、氯原子;故答案为:酯基、氯原子。
得到C中所含官能团的名称是酯基、氯原子;故答案为:酯基、氯原子。
⑵E的结构简式是 ,根据G、H的结构简式得到G→H的反应类型是消去反应;故答案为:
,根据G、H的结构简式得到G→H的反应类型是消去反应;故答案为: ;消去反应。
;消去反应。
⑶G与NaOH溶液发生酯的水解反应,其化学方程式是 ;故答案为:
;故答案为: 。
。
⑷①能够与氯化铁溶液发生显色反应,说明含有酚羟基;②能够与新制氢氧化铜浊液反应生成红色沉淀,说明含有醛基,③分子中除苯环外无其他环状结构,因此—OH和—CHO在邻位,—CH=CH2在苯环上有四种,—OH和—CHO在间位,—CH=CH2在苯环上有四种,—OH和—CHO在对位,—CH=CH2在苯环上有两种,—OH和—CH=CHCHO在邻、间、对位,—OH和![]() 在邻、间、对位,共16种;其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是
在邻、间、对位,共16种;其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是 ;故答案为:16;
;故答案为:16; 。
。
⑸![]() 与氢气在催化剂作用下发生加成反应生成
与氢气在催化剂作用下发生加成反应生成![]() ,
,![]() 与HCl发生取代反应生成
与HCl发生取代反应生成![]() ,
,![]() 和P(C6H5)3Cl反应生成
和P(C6H5)3Cl反应生成![]() ,
,![]() 和丙酮在N(C2H5)3作用下发生消去反应生成
和丙酮在N(C2H5)3作用下发生消去反应生成![]() ;因此合成路线流程图为:
;因此合成路线流程图为: ;故答案为:
;故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
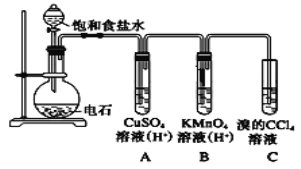
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
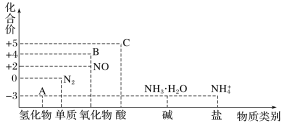
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一研究性学习小组对某工业城市的空气污染进行了下列研究。
(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有:A.使用石油液化气 B.燃烧含硫煤 C.粉尘污染另一同学认为还有一个不可排除的原因是:D______。目前城市空气污染的主要有害成分是______ (用化学式表示)。
(2)空气污染形成酸雨.研究性学习小组对该市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68.对此,你的合理的解释是______。
Ⅱ.在一密闭容器中发生反应 2NO2![]() 2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
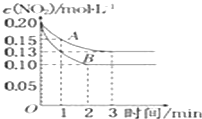
①依曲线A,反应在前3min内氧气的平均反应速率为______。
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是______ (填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5 (g) ![]() 4NO2 (g)+O2 (g)
4NO2 (g)+O2 (g)
②2NO2(g) ![]() 2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
则反应②中NO2的转化率为______,N2O5 (g)的起始浓度应不低于______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
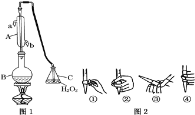
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的有几个()
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现![]() 与
与![]() 之间的相互转化
之间的相互转化
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]() ,
,![]() 为正四面体结构,其中P-P键的键能为
为正四面体结构,其中P-P键的键能为![]() ,
,![]() 的键能为
的键能为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.该反应在任何温度下都能自发
B.![]() 和
和![]() 具有的总能量比
具有的总能量比![]() 具有的能量低
具有的能量低
C.![]() 的电子式为:
的电子式为:![]()
D.![]() 键的键能为
键的键能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
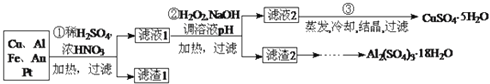
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
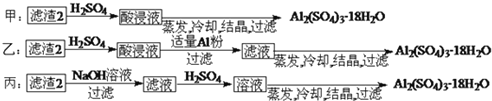
上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com