
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
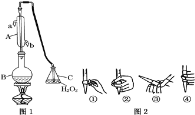
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 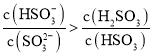
【答案】冷凝管 b ![]() ③ 酚酞 ④ 0.24 原因:盐酸的挥发,改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验 ADE
③ 酚酞 ④ 0.24 原因:盐酸的挥发,改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验 ADE
【解析】
(1)仪器A是冷凝管,为使冷凝效果好,所以b端是进水口,a端是出水口;
(2)二氧化硫与过氧化氢发生氧化还原反应生成硫酸;
(3)NaOH溶液应用碱式滴定管盛放,排气泡时应使尖嘴部分向上弯曲;滴定后的溶液显弱碱性,所以选择酚酞作指示剂,滴定管的液面在刻度“10”处;
(4)根据滴定消耗体积进行计算;
(5)该测定结果比实际值偏高,说明消耗氢氧化钠溶液的体积多,则待测液中的酸多,这是因为盐酸易挥发,使溶液酸的物质的量增大;
(6)根据离子浓度大小分析判断。
![]() 根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
![]() 双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:
双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:![]() ;
;
![]() 氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用
氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用![]() 的方法;滴定终点时溶液的
的方法;滴定终点时溶液的![]() ,应该选择酚酞做指示剂
,应该选择酚酞做指示剂![]() 酚酞的变色范围是
酚酞的变色范围是![]() ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积
;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积![]() ,所以
,所以![]() 正确;
正确;
![]() 根据
根据![]() 可知
可知![]() 的质量为:
的质量为:![]() ,该葡萄酒中的二氧化硫含量为:
,该葡萄酒中的二氧化硫含量为:![]() ;
;
![]() 由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响;
由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响;
![]() 常温下,用一定量的NaOH溶液吸收逸出的
常温下,用一定量的NaOH溶液吸收逸出的![]() 气体,吸收后的吸收液恰好呈中性,
气体,吸收后的吸收液恰好呈中性,![]() ,
,
A.依据溶液中电荷守恒:![]() ,得到
,得到![]() ,选项A正确;
,选项A正确;
B.若![]() ,溶液呈酸性
,溶液呈酸性![]() ,选项B错误;
,选项B错误;
C.物料守恒可知亚硫酸氢钠和亚硫酸钠按照1:1混合,溶液呈碱性,溶液中物料守恒为![]() ,但溶于呈中性,亚硫酸氢钠和亚硫酸钠的物质的量不同,选项C错误;
,但溶于呈中性,亚硫酸氢钠和亚硫酸钠的物质的量不同,选项C错误;
D.依据化学式可知,亚硫酸氢钠中硫元素物质的量和钠物质的量相同,亚硫酸钠中钠离子大于亚硫酸根中硫元素,所以![]() ,选项D正确;
,选项D正确;
E、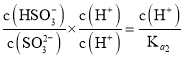
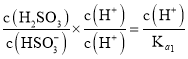
![]()
则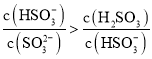 ,选项E正确;
,选项E正确;
答案选ADE。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.氮原子的价电子轨道排布式:![]()
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为纺锤形,能量也相等
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高一某研究性学习小组在化学实验研修时探究氢气还原氧化铜实验.
(1)理论计算:称取24.0g CuO进行实验,若H2足量,应该可以得到Cu的质量为______ g
(2)实验:待24.0g CuO完全变成红色固体,冷却,称量,得固体20.4g.这个反常现象激发了学生的兴趣;
(3)一组学生查阅资料:
Ⅰ.H2还原CuO时还可能得到氧化亚铜(CuO),CuO为红色固体,不溶于水;
Ⅱ.Cu2O能与稀硫酸反应:CuO+HSO=CuSO+Cu+HO;
Ⅲ.Cu2O能与稀硝酸反应:3CuO+14HNO(稀)=6Cu(NO)+2NO↑+7HO;
Ⅳ.Cu能与稀硝酸反应:3Cu+8HNO(稀)=3Cu(NO)+2NO↑+4HO;
讨论:可以选择足量的______(填“稀硫酸”或“稀硝酸”)判断红色固体中混有Cu2O; 现象是______;
(4)另一组学生认为通过计算,即可确认固体成分是Cu与Cu2O的混合物.20.4g红色固体中Cu2O的物质的量为______mol;将20.4g红色固体加入到体积为200mL足量的稀硝酸中,被还原的硝酸的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是____________(写名称)。
(2)蛋白质的水解产物具有的官能团是____________和____________(写结构简式)。
(3)葡萄糖是一种重要的单糖,其分子结构中除含有五个羟基外还含有的官能团是____________(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H[3—亚甲基异苯并呋喃—1(3H)—酮]常被用来合成药物。它的一种合成路线如图:
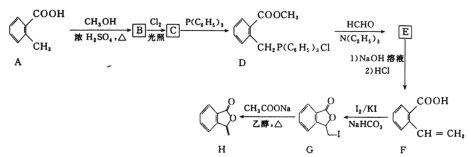
已知: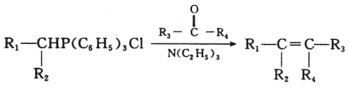 其中R1、R2、R3、R4为烃基或氢原子
其中R1、R2、R3、R4为烃基或氢原子
回答下列问题:
(1)C中所含官能团的名称是___。
(2)E的结构简式是___,G→H的反应类型是___。
(3)G与NaOH溶液反应的化学方程式是__。
(4)F的同分异构中符合下列条件的共有__种(不考虑立体异构)。
①能够与氯化铁溶液发生显色反应;
②能够与新制氢氧化铜浊液反应生成红色沉淀;
③分子中除苯环外无其他环状结构。
其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是__。
(5)写出以![]() 、P(C6H5)3、N(C2H5)3和丙酮(
、P(C6H5)3、N(C2H5)3和丙酮(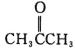 )为原料制备
)为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______,它属于______晶体。
(2)Y的氢化物属于______晶体,它的电子式是______。
(3)Z元素位于周期表的第______周期______族,它的氢化物是______性分子。
(4)X与Z形成的化合物可用电子式表示为______,其分子的空间构型是______体,属于______性分子,它的晶体属于______晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com