
【题目】X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______,它属于______晶体。
(2)Y的氢化物属于______晶体,它的电子式是______。
(3)Z元素位于周期表的第______周期______族,它的氢化物是______性分子。
(4)X与Z形成的化合物可用电子式表示为______,其分子的空间构型是______体,属于______性分子,它的晶体属于______晶体。
【答案】金刚石或石墨或足球烯 原子或过渡型或分子 分子 ![]() 三 ⅦA 极
三 ⅦA 极 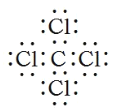 正四面体 非 分子
正四面体 非 分子
【解析】
由XH4中X的质量分数为75%可得![]() ×100%=75%,解得M(X)=12,则X为C元素;由X与Y能形成XY2型化合物可知,Y元素化合价为-2价,Y的氢化物为H2Y,由Y的质量分数为88.9%可得
×100%=75%,解得M(X)=12,则X为C元素;由X与Y能形成XY2型化合物可知,Y元素化合价为-2价,Y的氢化物为H2Y,由Y的质量分数为88.9%可得![]() ×100%=88.9%,解得M(Y)=16,由Y的原子核内质子数和中子数相等可知,Y的质子数为8,则Y为O元素;由Z的最高价氧化物的水化物是酸性最强的酸可知,Z为Cl元素。
×100%=88.9%,解得M(Y)=16,由Y的原子核内质子数和中子数相等可知,Y的质子数为8,则Y为O元素;由Z的最高价氧化物的水化物是酸性最强的酸可知,Z为Cl元素。
(1)X为C元素,C元素可以形成多种单质,如属于原子晶体的金刚石,属于过渡型晶体的石墨或属于分子晶体的足球烯,故答案为:金刚石或石墨或足球烯;原子或过渡型或分子;
(2)Y为O元素,O元素的氢化物为水,水为共价化合物,属于分子晶体,电子式为![]() ,故答案为:分子;
,故答案为:分子;![]() ;
;
(3)Z元素为Cl元素,位于周期表的第三周期ⅦA族,氯元素的氢化物为氯化氢,氯化氢分子为极性分子,故答案为:三;ⅦA;极;
(4)C元素与Cl元素形成的化合物为四氯化碳,四氯化碳为共价化合物,电子式为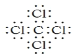 ;四氯化碳的空间构型为正四面体形,是结构对称的非极性分子,属于分子晶体,故答案为:
;四氯化碳的空间构型为正四面体形,是结构对称的非极性分子,属于分子晶体,故答案为: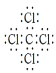 ;正四面体;非;分子。
;正四面体;非;分子。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为![]() 价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )
价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中,每个O2-周围距离最近的O2-有8个
C.晶体中与每个K+周围有8个O2-
D.晶体中,0价氧与-2价氧的数目比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
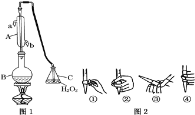
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 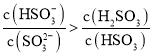
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]() ,
,![]() 为正四面体结构,其中P-P键的键能为
为正四面体结构,其中P-P键的键能为![]() ,
,![]() 的键能为
的键能为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.该反应在任何温度下都能自发
B.![]() 和
和![]() 具有的总能量比
具有的总能量比![]() 具有的能量低
具有的能量低
C.![]() 的电子式为:
的电子式为:![]()
D.![]() 键的键能为
键的键能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.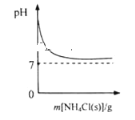 表示向NH3·H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化
表示向NH3·H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化
B.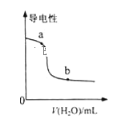 表示向NH3·H2O溶液中加水时溶液的导电性变化,则NH3·H2O溶液的pH:b>a
表示向NH3·H2O溶液中加水时溶液的导电性变化,则NH3·H2O溶液的pH:b>a
C.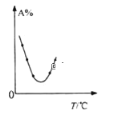 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)
表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)![]() B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0
B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0
D.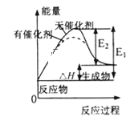 表示催化剂能改变化学反应的焓变
表示催化剂能改变化学反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
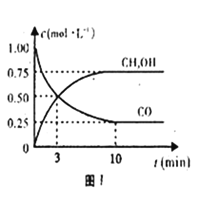
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=______。
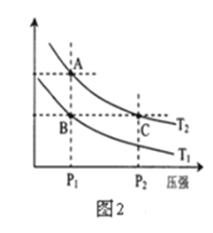
(2)图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(3)恒容条件下,下列措施中能使![]() 减小的有______
减小的有______
A.升高温度 B.充入He气 C.再充入2molCO和5molH2 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是__;
②只有还原性的是__;
③既有氧化性又有还原性的是__。
(2)已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子。
①反应中的被还原的微粒是__。
②x=__。
③参加反应的氢离子的物质的量为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com