
【题目】按要求填空。
(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是__;
②只有还原性的是__;
③既有氧化性又有还原性的是__。
(2)已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子。
①反应中的被还原的微粒是__。
②x=__。
③参加反应的氢离子的物质的量为__。
【答案】Fe3+、H+ Fe Fe2+ MnO4- 2 0.64mol
【解析】
(1)①微粒中所含元素化合价只能降低不能升高的微粒,只有氧化性;
②微粒中所含元素化合价只能升高不能降低的微粒,只有还原性;
③微粒中所含元素化合价既能升高又能降低的微粒,既有氧化性又有还原性。
(2)①反应中含有化合价降低元素的微粒被还原。
②可建立关系式RxO42-——xRO2,则0.2mol ×(4x-6)= 0.4mol ,由此可求出x。
③将方程式写出并配平,然后利用n(RxO42-)=0.2mol,求出参加反应的氢离子的物质的量。
(1)在Fe、Fe2+、Fe3+、H+中,Fe化合价只能升高不能降低;Fe2+化合价可升高到+3,也可降低到0;Fe3+化合价不能升高,只能降低到+2甚至0;H+化合价只能降低到0,不能升高。
①由以上分析知,只有氧化性的是Fe3+、H+;
②只有还原性的是Fe;
③既有氧化性又有还原性的是Fe2+。答案为:Fe3+、H+; Fe; Fe2+;
(2)在反应RxO42-+MnO4-+H+→RO2+Mn2++H2O中,MnO4-→Mn2+,Mn元素化合价由+7价降低为+2价,则由RxO42-→RO2,R元素的化合价升高。
①反应中被还原的微粒是含有化合价降低元素的反应物,应为MnO4-。
②可建立关系式RxO42-——xRO2,则0.2mol ×(4x-6)= 0.4mol ,求出x=2。
③将方程式写出并配平,即得5R2O42-+2MnO4-+16H+→10RO2+2Mn2++8H2O,n(RxO42-)=0.2mol,则参加反应的氢离子的物质的量为![]() =0.64mol。答案为:MnO4-;2;0.64mol。
=0.64mol。答案为:MnO4-;2;0.64mol。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______,它属于______晶体。
(2)Y的氢化物属于______晶体,它的电子式是______。
(3)Z元素位于周期表的第______周期______族,它的氢化物是______性分子。
(4)X与Z形成的化合物可用电子式表示为______,其分子的空间构型是______体,属于______性分子,它的晶体属于______晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL2mol/L的AlCl3溶液中加入1mol/L的KOH溶液,生成沉淀的质量为7.8g,加入溶液的体积可能为①100mL②300mL③700mL④800mL⑤1000mL()
A.①或②B.②或④C.②或③D.②或⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
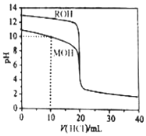
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中不能达到相应实验目的的是:
A | B | C | D | |
方案 |
| 在2mL1mol/LNaOH溶液中,加入5滴1mol/L氯化镁溶液,有白色沉淀,再加入5滴氯化铁溶液,观察沉淀颜色 | 实验室制备氢气,用粗锌代替纯锌与稀硫酸反应,反应速率加快 |
|
目的 | 探究浓度对化学反应速率的影响 | 探究沉淀溶解平衡的移动 | 探究形成原电池对反应速率的影响 | 探究温度对化学平衡的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
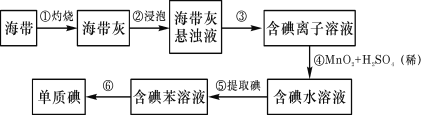
请填写下列空白:
(1)从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是____
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧
A.海带灼烧灰化,选用①②⑧ B.加水浸泡加热,选用②④⑦
C.过滤得到滤液,选用④⑤⑦ D.萃取和分液,选用③④⑥
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是_____。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小于水
c.碘在苯中溶解度大于水 d.苯与水互不相溶
提取碘的过程中,不能使用的有机溶剂是__________。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(3)步骤④中MnO2的作用是__________(选填:氧化剂、还原剂、催化剂)。
(4)单质碘有许多用途,其中之一是生产加碘食盐中的碘剂——碘酸钾(KIO3)。合格加碘食盐含碘量(以I计)为20-50mg/Kg,则每千克该加碘食盐中碘酸钾的最小质量为_____ mg。
(5)已知:2Fe3++2I-=2Fe2++I2 氯气既可以氧化Fe2+,也可以氧化I-。往200mLFeI2溶液中通入8.96L(标准状况)Cl2,反应完成后,溶液中有![]() Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com