
【题目】下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
【答案】D
【解析】
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水不影响配制溶液,由于溶质的物质的量不变,溶液的体积也不变,所以根据![]() ,可知溶液的物质的量浓度不变,错误;
,可知溶液的物质的量浓度不变,错误;
B.用盐酸标准溶液滴定未知浓度氨水,由于二者反应产生的盐NH4Cl水解使溶液显酸性,所以选用酸性范围内变色的甲基橙比选择碱性范围内变色的酚酞,测定的结果会更准确,B错误;
C.由于空气中含有水蒸气,在空气中冷却,会导致部分水分被吸收,使测得的结晶水数目偏低,C错误;
D. 测定中和热时,为减少实验过程中的热量损失,应在有保温措施的容器内迅速将酸、碱稀溶液混合、搅拌,并及时记录反应达到的最高温度数值,D正确;
故本题合理答案是D。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:
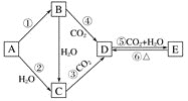
(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则

A. M点所示溶液导电能力强于Q点
B. N点所示溶液中c(CH3COO-)﹥c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是

A. 断开K2,闭合K1时,铜电极为阳极
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极发生还原反应
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______
(2)元素⑦的原子结构示意图是____________。
(3)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:________(写氢化物的化学式)。
(
(5)元素⑤的单质在氧气中燃烧所得产物中化学键的类型为_____________________
(6)用电子式表示①与⑨反应得到的化合物的形成过程_______________。
(7)两种均由①④⑤⑦四种元素组成的化合物,在水溶液中发生反应的离子反应方程式为________
(8)第三周期元素Na Mg Al S Cl 的简单离子半径由大到小的顺序是______(用离子符号表示)
(9)已知1g①的单质燃烧生成液态产物时放出142.9kJ的热量,写出表示该单质燃烧热的热化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应2SO2+O2![]() 2SO3,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需20s,那么由0.06 mol·L-1降到0.024mol·L-1需要的反应时间为
2SO3,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需20s,那么由0.06 mol·L-1降到0.024mol·L-1需要的反应时间为
A. 等于18sB. 等于12sC. 大于18sD. 小于18s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
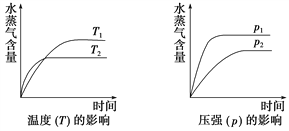
A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是最重要的铜矿,全世界三分之二的铜是由它提炼的。
铜矿冶炼过程中发生的反应有:2CuFeS2+O2=Cu2S+2FeS+SO2 ;2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2
回答下列问题:
(1)Cu属于_____区的元素,黄铜矿中铜离子基态外围电子排布式为_____________。
(2)铜矿冶炼过程中产生的SO2可用于生产硫酸,SO2的空间构型为___________,中心原子的杂化方式为__________。冶炼过程还产生了Cu2S 、Cu2O,其中熔点较高的是______________,原因是_______________。
(3)黄铜矿不溶于稀硫酸,但可以溶解在稀硝酸中,硝酸将其中的铁、硫元素氧化到高价态,可以用黄血盐K4[Fe(CN)6]检验Fe3+的存在,1 mol K4[Fe(CN)6]中含有的σ键的数目为_______________。
(4)Cu2O晶体的晶胞如图所示,晶胞的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则Cu原子配位数为__________,最近的两个O原子之间的距离为____________nm。
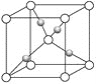
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com