
【题目】向100mL2mol/L的AlCl3溶液中加入1mol/L的KOH溶液,生成沉淀的质量为7.8g,加入溶液的体积可能为①100mL②300mL③700mL④800mL⑤1000mL()
A.①或②B.②或④C.②或③D.②或⑤
【答案】C
【解析】
100mL2mol/L的AlCl3溶液中氯化铝的物质的量n=0.1L![]() 2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol
2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol![]() 78g/mol=15.6g>7.8g,说明有两种情况:可能沉淀不完全,只生成Al(OH)3沉淀;也可能沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,由n(Al(OH)3)=
78g/mol=15.6g>7.8g,说明有两种情况:可能沉淀不完全,只生成Al(OH)3沉淀;也可能沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,由n(Al(OH)3)=![]() =0.1mol,①若碱不足,由Al3++3OH- =Al(OH)3↓可知NaOH的物质的量为=0.1mol
=0.1mol,①若碱不足,由Al3++3OH- =Al(OH)3↓可知NaOH的物质的量为=0.1mol![]() 3=0.3mol,加入NaOH溶液的体积=
3=0.3mol,加入NaOH溶液的体积=![]() =0.3L=300 mL;
=0.3L=300 mL;
②若沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,根据Al3++3OH-=Al(OH)3↓可知0.2mol Al3+完全反应消耗0.6mol OH-,生成0.2mol Al(OH)3沉淀,溶解的氢氧化铝为0.2mol-0.1mol=0.1mol,根据Al(OH)3+OH-=AlO2-+2H2O,则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,加入NaOH溶液的体积=![]() =0.7L=700 mL,所以②或③符合题意;
=0.7L=700 mL,所以②或③符合题意;
所以答案:C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:
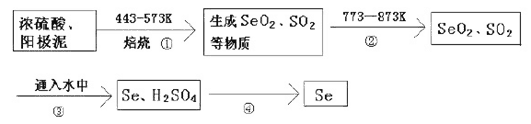
(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为_____________________________________。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL,则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是__;
②只有还原性的是__;
③既有氧化性又有还原性的是__。
(2)已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子。
①反应中的被还原的微粒是__。
②x=__。
③参加反应的氢离子的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
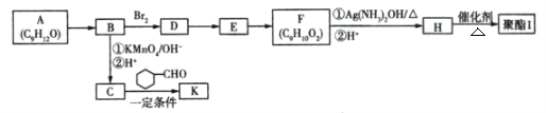
已知:①A的苯环上只有一个支链,支链上有两种不同化学环境的氢原子;
②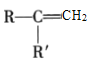
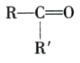 +CO2
+CO2
③![]()
回答下列问题:
(1)A生成B的反应条件为____,由D生成E的反应类型为_________。
(2)F中含有的官能团名称为________。
(3)K中含有两个六元环,则K的结构简式为 ______。
(4)由F生成H过程中①的化学方程式为_______ 。
(5)H有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式 __________。
①能发生银镜反应 ⑦遇FeCl3溶液显色 ③具有4组核磁共振氢谱峰
(6)糠叉丙酮![]() 是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛
是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛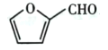 为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________
为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )

A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
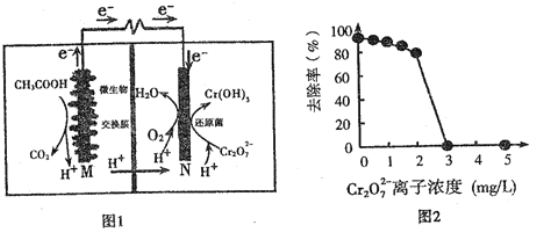
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com