
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )

A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B、C、D在一定条件下均能与二氧化碳反应。
(1)A是___;B是___;C是___;D是___。(填化学符号)
(2)完成下列方程式:
B与H2O反应的化学方程___。
向C的稀溶液中通入CO2的离子方程式____。
A与H2O反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GMA可用作涂料、离子交换树脂和油墨的黏合剂等,通过酯交换反应制备,反应如下:
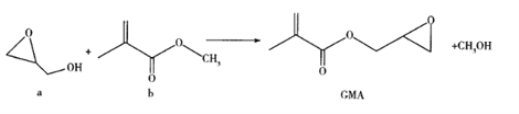
下列说法错误的是( )
A.与a互为同分异构体的羧酸只有1种
B.b分子中的所有C原子和O原子可能在同一平面内,含有三种官能团
C.GMA的分子式为C7H10O3
D.GMA能与NaOH溶液、溴水、酸性KMnO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。主要实验装置(回流搅拌装置)如图所示:
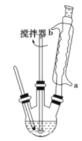
反应原理:
![]() +2KMnO4→
+2KMnO4→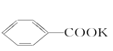 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
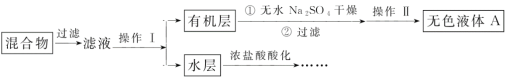
(1)无色液体A的结构简式为___,操作Ⅱ为___;
(2)如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是___,写出该反应的离子方程式:___;
(3)冷却水应该从冷凝管___(填“a”或“b”)口流入;
(4)要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(5)纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
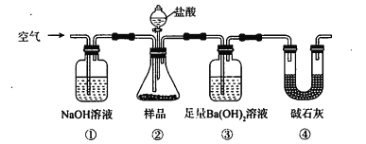
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
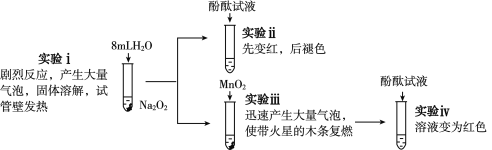
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请回答以下问题。
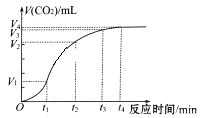
(1)化学反应速率最快的时间段是_________,原因是________________。
A.0~t1 B.t1-t2 C. t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有_________。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.通入HCl
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)=________________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
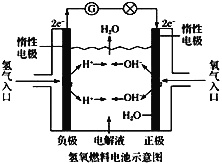
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com