
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
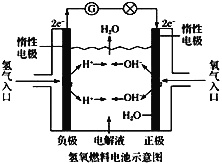
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
【答案】2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大 2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 变小
【解析】
氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,总反应为2H2+O2=2H2O;随着酸碱环境的不同,两极极反应方程式也不同,据此进行分析。
(1)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,酸性溶液中负极反应为:2H2-4e-=4H+,通入氧气的一极为原电池的正极,发生还原反应,酸性溶液中正极反应为:O2+4e-+4H+=2H2O,电池总反应为2H2+O2=2H2O;反应生成水,溶液氢离子浓度降低,pH增大;
故答案为:2H2-4e-=4H+ ;O2+4e-+4H+=2H2O;2H2+O2=2H2O;变大;
(2)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,通入氧气的一极为原电池的正极,发生还原反应,碱性溶液中正极反应为O2+4e-+2H2O=4OH-,电池总反应为2H2+O2=2H2O;反应生成水,溶液氢氧根离子离子浓度降低,pH减小;
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;变小。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )

A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(无色液体,难溶于水,沸点213℃)天然存在于桃、菠萝、红茶中,稍有水果气味,常用于配制香精和人造精油,也可用作食品添加剂。实验室利用如图所示装置,在环己烷中通过反应 制备。已知:环己烷沸点为80.8℃,可与乙醇和水形成共沸物,其混合物沸点为62.1℃。下列说法错误的是( )
制备。已知:环己烷沸点为80.8℃,可与乙醇和水形成共沸物,其混合物沸点为62.1℃。下列说法错误的是( )

A.实验时最好采用水浴加热,且冷却水应从b口流出
B.分水器可及时放出水层,避免水层升高流入烧瓶
C.环己烷的作用是在较低温度下带出生成的水,促进酯化反应向右进行
D.实验时应依次向圆底烧瓶中加入碎瓷片、浓硫酸、苯甲酸、无水乙醇、环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
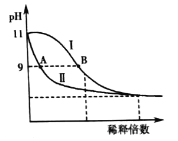
【题目】25℃时,分别稀释![]() 的
的![]() 溶液和氨水,溶液pH的变化如下图所示。
溶液和氨水,溶液pH的变化如下图所示。
已知:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.若35℃时分别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来靠近
B.保持25℃不变,取A、B两点对应的溶液等体积混合后,![]()
C.由水电离产生的![]() :A点>B点
:A点>B点
D.曲线Ⅰ上任意点对应的溶液中,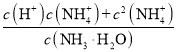
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)焰色反应的光谱属于发射光谱,铜和含铜离子化合物的焰色为_______色。
(2)基态Ni原子中,核外电子占据的最高能层符号是________,其核外电子排布式中未成对电子数为_________个。
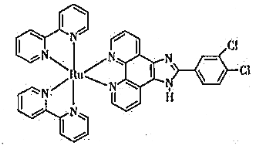
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如下图所示。钌(Ⅱ)的配位数是_______,N原子的杂化类型为______________。
(4)![]() 晶体中,
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙。
围成的正八面体空隙。![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和全部
和全部![]() 填充在正八面体空隙中,则
填充在正八面体空隙中,则![]() 晶体中,正八面体空隙数与
晶体中,正八面体空隙数与![]() 数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。
数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。![]() 晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________
晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________![]() (写出含a和
(写出含a和![]() 的计算表达式)。
的计算表达式)。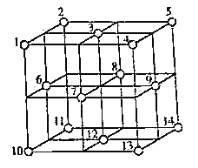
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
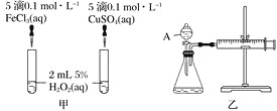
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
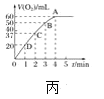
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图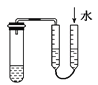 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图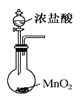 装置制备氯气
装置制备氯气
C.利用图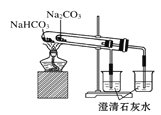 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图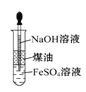 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸铝和硫酸镁的混合液中,c(Mg2+)=2mol/L,c(S042-)=6.5mol/L,若将100 mL的此混合液中的Mg2+和Al3+分离,至少应加入1.6mol/L的氢氧化钠溶液 ( )
A.1.0LB.0.5 LC.1.8LD.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入NaOH溶液中:2OH-+Cl2=Cl-+ClO-+H2O
C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.AlC13溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com