
【题目】下列离子方程式的书写正确的是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入NaOH溶液中:2OH-+Cl2=Cl-+ClO-+H2O
C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.AlC13溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
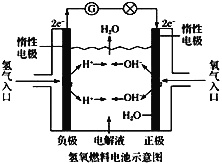
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+![]()
B.电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+![]() +5H2O=10H++2
+5H2O=10H++2![]() +8Cl-
+8Cl-
D.将0.2mol·L-1的NH4Al(SO4)2溶液与0.4mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是
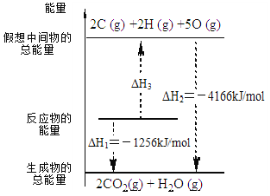
A.840B.1590C.900D.1250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法错误的是
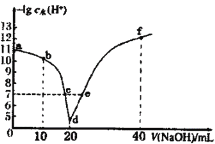
A.从d点以后至f点,H2O的电离程度一直减小
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.b点的溶液呈酸性,粒子浓度之间存在:c(HA)+2c(H+)=2c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
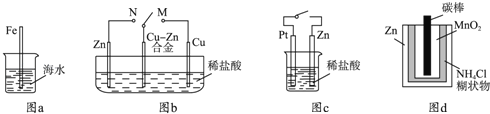
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂。实验室制取POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。采用氧气氧化液态PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
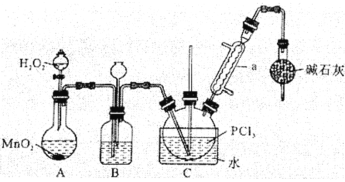
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体;遇水均剧烈水解为含氧酸和氯化氢;两者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为______。
(2)装置C中生成POCl3的化学方程式为__________。
(3)装置B的作用除观察O2的流速之外,还有_________、________。
(4)反应温度应控制在60-65℃之间,原因是__________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①实验Ⅰ结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725gPOCl3,产品,置于盛60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯离子完全沉淀;向其中加入少量硝基苯并用力摇动。
③以硫酸铁溶液为指示剂,用0.2 mol·L-1KSCN溶液滴定过量的AgNO3溶液,达滴定终点时共用去10.00mLKSCN溶液。
己知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)达滴定终点时的现象为____________。
(6)实验过程中加入硝基苯的目的是__________;若无此操作,则所测POCl3的含量将____________(填“偏高”、“偏低”或“不变”)。
(7)测得产品POCl3的百分含量为________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图。请回答下列问题:

(1)写出基态Cu的外围电子排布式_____________________________________。
(2)配体氨基乙酸根(H2NCH2COOˉ)受热分解可产生CO2和N2,N2中σ键和π键数目之比是__________;N2O与CO2互为等电子体,则N2O的电子式为____________。
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醛分子中HCO的键角_____(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在如图中表示出来_____。

(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;

(5)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为______。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列说法正确的是( )
CH3COO-+H+,下列说法正确的是( )
A. 向10mLpH=5的CH3COOH溶液中加水至10L,最后溶液pH在7和8之间
B. 加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
C. 加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D. 向10mLpH=5的CH3COOH溶液中加入等体积,等浓度的盐酸,混合溶液的c(H+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com