
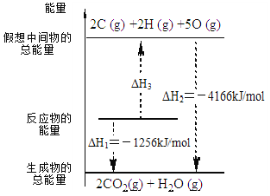
【题目】电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是
A.840B.1590C.900D.1250
【答案】A
【解析】
根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可.
根据图中内容,可以看出C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH =-1256kJ/mol
则C2H2(g) + 5/2 O2(g)==2C+2H+5O △H=4166-1256=2910kJ/mol
化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molC≡C 键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391.
410![]() 2+K+2.5
2+K+2.5![]() 500=2910 kJ/mol
500=2910 kJ/mol
K=2910-410![]() 2-2.5
2-2.5![]() 500==840 kJ/mol
500==840 kJ/mol
故选A。


科目:高中化学 来源: 题型:
【题目】25℃时,分别稀释![]() 的
的![]() 溶液和氨水,溶液pH的变化如下图所示。
溶液和氨水,溶液pH的变化如下图所示。
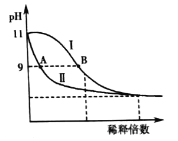
已知:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.若35℃时分别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来靠近
B.保持25℃不变,取A、B两点对应的溶液等体积混合后,![]()
C.由水电离产生的![]() :A点>B点
:A点>B点
D.曲线Ⅰ上任意点对应的溶液中,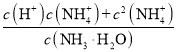
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸铝和硫酸镁的混合液中,c(Mg2+)=2mol/L,c(S042-)=6.5mol/L,若将100 mL的此混合液中的Mg2+和Al3+分离,至少应加入1.6mol/L的氢氧化钠溶液 ( )
A.1.0LB.0.5 LC.1.8LD.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.分子式符合C8H8的有机物都能使酸性高锰酸钾溶液褪色
B.存在立体异构的链烃中,碳原子数最少的一定是2-丁烯
C.葡萄糖与核糖互为同系物
D.C8H8O2芳香族化合物分子中可能含有两个醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如图:
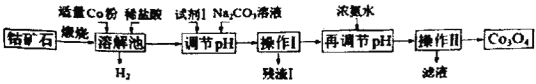
己知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
氢氧化物 | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
溶度积(Ksp) | 2.0×10-15 | 8.0×10-16 | 2.0×10-44 | 1.3×10-33 | 4.0×10-39 |
下列有关说法错误的是
A.溶解池中生成H2的离子反应方程式为:Co+2H+=Co2++H2↑
B.加入试剂1的目的是将Fe2+氧化为Fe3+,试剂1可选用双氧水或碘水
C.残渣1的主要成分为Fe(OH)3
D.操作Ⅱ包括过滤、洗涤、干燥和灼烧四个步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入NaOH溶液中:2OH-+Cl2=Cl-+ClO-+H2O
C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.AlC13溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 molBaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某化工厂对海水资源综合利用的示意图:
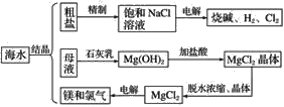
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性。请写出加入盐酸后发生反应的离子方程式:____________________________。
(2)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起____________作用?
(3)海水里的镁元素处于游离态还是化合态_________?从海水中提取氯化镁的反应是不是氧化还原反应_________?为什么_________________?
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却?________。
A.H2
B.CO2
C.空气
D.O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com