
����Ŀ��Co3O4���Ʊ�ʯīϩ�����������LiCoO2��ԭ�ϡ����ܿ�ʯ(��Ҫ�ɷ�ΪCo3S4����������FeO��Fe2O3��Al2O3������)Ϊԭ����ȡCo3O4�Ĺ���������ͼ��
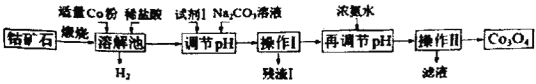
��֪��Co��FeΪ���ý�������������ǿ������˳��Ϊ��Co3+��Fe3+��Co2+��
��������������ܶȻ����±���
�������� | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
�ܶȻ�(Ksp) | 2.0��10��15 | 8.0��10��16 | 2.0��10��44 | 1.3��10��33 | 4.0��10��39 |
�����й�˵���������
A.�ܽ��������H2�����ӷ�Ӧ����ʽΪ��Co+2H+=Co2++H2��
B.�����Լ�1��Ŀ���ǽ�Fe2+����ΪFe3+���Լ�1��ѡ��˫��ˮ���ˮ
C.����1����Ҫ�ɷ�ΪFe(OH)3
D.������������ˡ�ϴ�ӡ�����������ĸ�����
���𰸡�BC
��������
�ܿ�ʯ��Ҫ�ɷ�ΪCo3S4����������FeO��Fe2O3��Al2O3�����ʣ����պ��������ܽ⣬��Һ����������Ҫ��Co3+��Fe3+��Al3+��δ��Ӧ��H+������Co�ۻ����������ɣ�����������Co3+��Fe3+��Co2+��Co��Co3+��Fe3+��ԭΪCo2+��Fe2+�����ݼ�������������ܶȻ����ݣ���Ҫ��Fe2+ת��ΪFe3+��ȥ����˼����Լ�1��Ŀ���ǽ�Fe2+����ΪFe3+������̼���Ƶ���pH��ʹFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3���������˳�ȥ����Һ�м���Ũ��ˮ����pHʹCo2+ת��ΪCo(OH)2���������˷��룬Co(OH)2���յõ�Co3O4����Һ�к����Ȼ��ơ��Ȼ�淋ȡ��ݴ˷������
A��Co��HCl�����û���Ӧ����CoCl2��H2����Ӧ���ӷ���ʽΪ��Co+2H+=Co2++H2������A��ȷ��
B���Լ�1�ǽ�Fe2+����ΪFe3+����ˮ���ܽ�Fe2+����ΪFe3+��˫��ˮ���Խ�Fe2+����ΪFe3+���һ�ԭ����Ϊˮ����B����
C������̼���Ƶ���pH��ʹFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3����������I����Ҫ�ɷ�Ϊ��Fe(OH)3��Al(OH)3����C����
D���������ǽ�Co(OH)2������Һ����룬Ȼ��Co(OH)2��������Co3O4��������������ˡ�ϴ�ӡ���������ĸ����裬��D��ȷ��
��ѡBC��


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1�������£���pH��ͬ�������ͬ�Ģ�����͢ڴ���������Һ����ȡ���´�ʩ��
�ټ����������ƾ��������Һ�е�c(H��)�仯�Ǵ�����Һ��c(H��)___(����������������С������������)��������Һ��c(H��)___(����������������С������������)��
�ڼ�ˮϡ��10��������Һ�е�c(H��)___������Һ�е�c(H��)(����>��������������<��)��
�ۼӵ�Ũ�ȵ�NaOH��Һ��ǡ���кͣ�����NaOH��Һ�����������___����(����>��������������<��)��
��ʹ�¶ȶ�����20�棬��Һ��c(H��)������___����(����>��������������<��)��
�ݷֱ���������п�۷�����Ӧ�����й����������(V)��ʱ��(t)�仯��ʾ��ͼ��ȷ����___(����ĸ)��
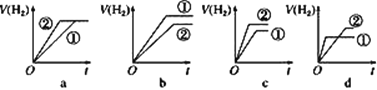
��2����0.1mol��L��1��CH3COOH��ˮϡ�ͣ��й�ϡ�ͺ������Һ��˵���У���ȷ����___(����ĸ)��
a.����̶����� b.��Һ��������������
c.��Һ��������ǿ d.��Һ�д����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���2mol A��2mol B������������2L�ܱ������У�������Ӧ3A(g)+B(g)xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬������0.8mol D�������C��Ũ��Ϊ0.4mol/L���ɴ��ƶϣ�
��1��xֵ����______________
��2��B��ƽ��Ũ��Ϊ_____________
��3��A��ת����Ϊ____________
��4������D�ķ�Ӧ����______________
��5���������Ӧ��ϵ��ѹǿ����ƽ����ϵ��C����������____________������������������С��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��F�Ǽ��������ӵ����ģ��(����ͼ)���ݴ˻ش��������⣺
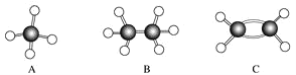
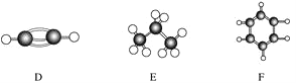
��1������ͬϵ�����________��
��2�������º�̼����ߵ���̬���ķ���ʽ��____________________________________��
��3���ܹ������ӳɷ�Ӧ������(������)________�֣�
��4��д��C��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ________________��
��5��д��F���巢��ȡ����Ӧ�Ļ�ѧ����ʽ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ����һ�ֳ���ȼ�ϣ�C2H2(g) + 5/2 O2(g) �� 2CO2(g) + H2O(l) ��H �йػ�ѧ��Ӧ�������仯����ͼ��ʾ����֪����1mol��ѧ�������������kJ����O=OΪ500��C-HΪ410�������1molC��C �������������kJ����
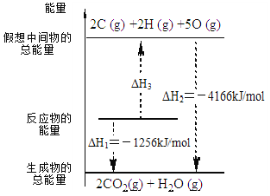
A.840B.1590C.900D.1250
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(CN)2������(SCN)2�ȳ�Ϊ��±�أ�������±�ص����������ƣ����ǵ�������Ҳ��±���������������ơ����磺2Fe��3(SCN)2==2Fe(SCN)3��Ag����CN��== AgCN��(��)����±���γɵ�������ͺ�����һ�����±��ʹ�±�����������ӵĻ�ԭ��һ���Br��ǿ�����з�Ӧ�У�����ȷ���ǣ� ��
A. 2CN����Cl2= 2Cl����(CN)2
B. (CN)2��2OH��=CN����CNO����H2O
C. (SCN)2��H2O = 2H����SCN����SCNO��
D. MnO2��4HSCN��Ũ��![]() (SCN)2����Mn(SCN)2��2H2O
(SCN)2����Mn(SCN)2��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʴ�йص�˵����ȷ���ǣ�������
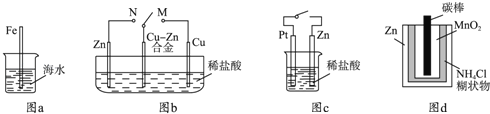
A.ͼa�У����뺣ˮ�е�������Խ�����˸�ʴԽ����
B.ͼb�У�������M������Nʱ��Cu��Zn�Ͻ�ĸ�ʴ���ʼ�С
C.ͼc�У���ͨ����ʱZn��ʴ��������Zn�Ϸų����������Ҳ����
D.ͼd�У�Zn��MnO2�ɵ���Էŵ縯ʴ��Ҫ����MnO2���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ (ͼ�� HA ��ʾ������ӣ�A - ��ʾ���������) ������˵����ȷ����( )
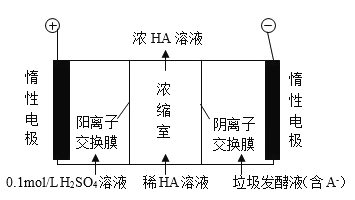
A.ͨ����������� pH ����
B.���ӴӸ������������Һ�ص�����
C.����·��ͨ�� 2mol ���ӵĵ���ʱ������ 1mol �� O2 ����
D.ͨ��� A- ͨ�������ӽ���Ĥ����������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.05molij�л���A��0.125molO2��һ�ܱ������г��ȼ�գ����ò���ͨ��ŨH2SO4ʱʹ������2.7g����ͨ���������ȵ�CuO��ĩ������������С��0.8g�����ͨ��������ʯ�ң���������������6.6g��
��1���û�����A�ķ���ʽ______________����д��������̣�
��2����0.05mol����ȩ�����л���B���л���A�����ʽ��ͬ������0.125molO2������ȫȼ�գ�д��B���п��ܵĽṹ��ʽ______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com