
【题目】25℃时,分别稀释![]() 的
的![]() 溶液和氨水,溶液pH的变化如下图所示。
溶液和氨水,溶液pH的变化如下图所示。
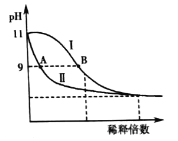
已知:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.若35℃时分别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来靠近
B.保持25℃不变,取A、B两点对应的溶液等体积混合后,![]()
C.由水电离产生的![]() :A点>B点
:A点>B点
D.曲线Ⅰ上任意点对应的溶液中,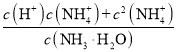
![]()
【答案】BD
【解析】
25℃时,Ba(OH)2溶液和氨水的pH相同,由于Ba(OH)2是强电解质,完全电离,稀释100倍时,Ba(OH)2的pH从11变为9,而氨水是弱电解质,部分电离,稀释100倍时,稀释过程中氨水会继续电离出OH-,导致溶液中OH-的浓度大于Ba(OH)2溶液中的OH-,溶液的pH>9,因此曲线Ⅰ代表氨水稀释时溶液pH随稀释倍数的变化,曲线Ⅱ代表Ba(OH)2溶液稀释时溶液pH随稀释倍数的变化,据此分析解答问题。
A.温度升高,Kw变大,则在35℃时分别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来疏远,A选项错误;
B.25℃时,A、B两点对应的溶液的pH均为9,保持25℃不变,则Kw不变,两者等体积混合后,溶液中H+浓度不变,故pH仍不变,B选项正确;
C.氨水是弱电解质,部分电离,稀释过程中氨水会继续电离出OH-,导致溶液中OH-的浓度大于Ba(OH)2溶液中的OH-,故稀释至相同pH=9时稀释倍数大于100倍,则水电离产生的H+浓度:A点<B点,C选项错误;
D.曲线Ⅰ上任意点对应的溶液中存在电荷守恒:c(OH-)=c(H+)+c(NH4+),则有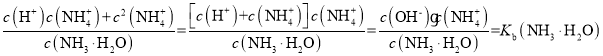 =1.8×10-5mol·L-1,D选项正确;
=1.8×10-5mol·L-1,D选项正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请回答以下问题。
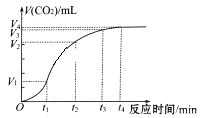
(1)化学反应速率最快的时间段是_________,原因是________________。
A.0~t1 B.t1-t2 C. t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有_________。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.通入HCl
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)=________________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)常温下,有pH相同、体积相同的①盐酸和②醋酸两种溶液,采取以下措施:
①加适量醋酸钠晶体后,两溶液中的c(H+)变化是醋酸溶液中c(H+)___(填“增大”、“减小”或“不变”),盐酸溶液中c(H+)___(填“增大”、“减小”或“不变”)。
②加水稀释10倍后,醋酸溶液中的c(H+)___盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸___盐酸(填“>”、“=”或“<”)。
④使温度都升高20℃,溶液中c(H+):醋酸___盐酸(填“>”、“=”或“<”)。
⑤分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___(填字母)。
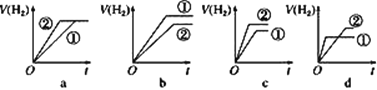
(2)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是___(填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
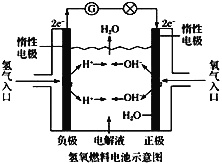
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.4.8g金属镁变为Mg2+时失去的电子数为0.2NA
B.6.2gNa2O中含有的阴离子数为0.1NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是
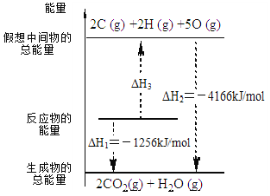
A.840B.1590C.900D.1250
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com