
【题目】自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)焰色反应的光谱属于发射光谱,铜和含铜离子化合物的焰色为_______色。
(2)基态Ni原子中,核外电子占据的最高能层符号是________,其核外电子排布式中未成对电子数为_________个。
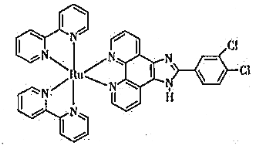
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如下图所示。钌(Ⅱ)的配位数是_______,N原子的杂化类型为______________。
(4)![]() 晶体中,
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙。
围成的正八面体空隙。![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和全部
和全部![]() 填充在正八面体空隙中,则
填充在正八面体空隙中,则![]() 晶体中,正八面体空隙数与
晶体中,正八面体空隙数与![]() 数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。
数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。![]() 晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________
晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________![]() (写出含a和
(写出含a和![]() 的计算表达式)。
的计算表达式)。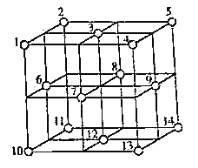
【答案】绿 N 2 6 ![]() 、
、![]()
![]()
![]()
![]()
【解析】
(1)因为铜和含铜离子化合物在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高的轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,放出的光的颜色为绿色,故答案为:绿;
(2)基态Ni原子为28号元素,核外电子排布式为1s22s22p63s23p63d84s2,核外电子占据的最高能层的符号为N,其核外电子排布式中未成对电子数为2个,故答案为:N;2;
(3)由钌-多吡啶配合物的结构简式可知,Ru与6个N形成配位键,则钌(Ⅱ)的配位数为6,N原子形成了单键和双键,则杂化方式为sp2、sp3,故答案为:6;sp2、sp3;
(4)根据题干信息,Fe3O4晶胞结构中正四面体空隙数为8,正八面体空隙数为4,O2-位于顶点和面心,个数为8×1/8+6×1/2=4,因此正八面体空隙和O2-数之比为4:4=1:1,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和全部Fe2+填充在正八面体空隙中,则正四面体的空隙填充率为![]() ,即12.5%,正八面体的空隙填充率为50%,两者之比为:12.5%:50%=1:4,Fe3O4的晶胞中有8个图示结构单元,则晶胞的质量
,即12.5%,正八面体的空隙填充率为50%,两者之比为:12.5%:50%=1:4,Fe3O4的晶胞中有8个图示结构单元,则晶胞的质量![]() ,体积V=a3×10-30cm3,则晶体的密度
,体积V=a3×10-30cm3,则晶体的密度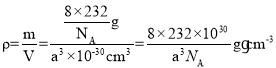 ,故答案为:1:1;1:4;
,故答案为:1:1;1:4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。主要实验装置(回流搅拌装置)如图所示:
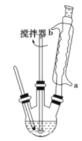
反应原理:
![]() +2KMnO4→
+2KMnO4→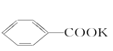 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
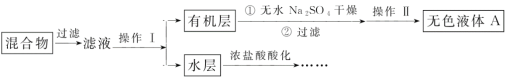
(1)无色液体A的结构简式为___,操作Ⅱ为___;
(2)如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是___,写出该反应的离子方程式:___;
(3)冷却水应该从冷凝管___(填“a”或“b”)口流入;
(4)要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(5)纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,现有pH=2的HCl溶液100mL,要使它的pH=3,如果加入蒸馏水,需加水______________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液_____________mL。(假定溶液体积有加和性,下同)
(2)25℃时,将pH=8的NaOH溶液与pH=13的NaOH溶液等体积混合后,溶液的pH=________________。(lg2=0.3)
(3)25℃时,将0.1mol·L-1盐酸和0.06mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=___________。
(4)25℃时,pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对实验室中的一种白色固体进行鉴别,实验探究如下:
①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;
②用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰;
③取少量溶液A加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;
④另取少量溶液A加入硫粉,加热,硫溶解生成无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和刺激性气味的气体;若将溶液B加入![]() 沉淀中,沉淀溶解。
沉淀中,沉淀溶解。
下列叙述错误的是( )
A.由实验可推测该白色固体为![]() 或
或![]()
B.实验③发生的离子方程式可能为![]()
![]()
C.实验④中生成无色溶液B的化学方程式为:![]()
D.由实验④可知![]() 可以和
可以和![]() 形成配合物
形成配合物![]() 而溶解
而溶解![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
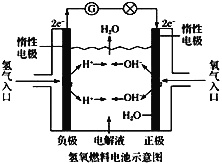
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法错误的是
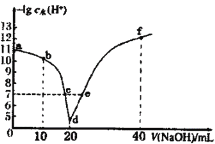
A.从d点以后至f点,H2O的电离程度一直减小
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.b点的溶液呈酸性,粒子浓度之间存在:c(HA)+2c(H+)=2c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com