
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
【答案】B
【解析】
A. 同种物质熵值,气体大于液体大于固体
B. 自发进行的反应速率取决于物质的性质和外界条件;
C. 该反应为熵增加的反应,利用复合判据分析;
D. 反应C(s)+CO2(g)=2CO(g)不能自发进行,ΔG=△H-TΔS>0,据此判断。
A. 同种物质熵值,气体大于液体大于固体,A项正确;
B. 自发进行的反应速率取决于物质的性质和外界条件,不一定能迅速发生,B项错误;
C. 该反应为熵增加的反应,即ΔS>0,又△H>0,ΔG=△H-TΔS<0时反应自发进行,因此,该反应能否自发进行与温度有关,C项正确;
D. 反应C(s)+CO2(g)=2CO(g)不能自发进行,ΔG=△H-TΔS>0,又ΔS>0,则△H>0,D项正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.Na与H2O反应:Na+H2O=Na++OH-+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
D.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的转化关系中(反应条件略去),常温下X为气体,a、b、c是中学化学中常见物质,均由常见元素组成。下列说法正确的是( )

A.若X为![]() ,a为一种固态单质,则c可能为
,a为一种固态单质,则c可能为![]() 或
或![]()
B.若a、b、c的焰色反应均呈黄色,水溶液均呈碱性,则a中可能含有非极性共价键
C.若b为固态非金属单质,b与X所含元素同主族,则c与X不能反应
D.若b为气态非金属单质,X与b所含元素同周期,则a与c在一定条件下可以反应生成b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)焰色反应的光谱属于发射光谱,铜和含铜离子化合物的焰色为_______色。
(2)基态Ni原子中,核外电子占据的最高能层符号是________,其核外电子排布式中未成对电子数为_________个。
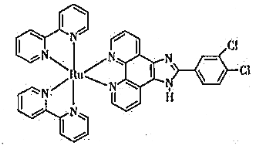
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如下图所示。钌(Ⅱ)的配位数是_______,N原子的杂化类型为______________。
(4)![]() 晶体中,
晶体中,![]() 的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的![]() 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的![]() 围成的正八面体空隙。
围成的正八面体空隙。![]() 中有一半的
中有一半的![]() 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半![]() 和全部
和全部![]() 填充在正八面体空隙中,则
填充在正八面体空隙中,则![]() 晶体中,正八面体空隙数与
晶体中,正八面体空隙数与![]() 数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。
数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。![]() 晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________
晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________![]() (写出含a和
(写出含a和![]() 的计算表达式)。
的计算表达式)。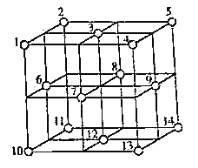
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)![]() xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图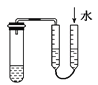 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图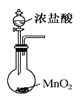 装置制备氯气
装置制备氯气
C.利用图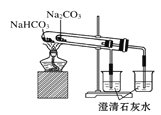 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图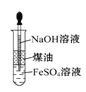 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。

(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 molL-1的HNO3溶液,但是在实验室中只发现一瓶8 molL-1的HNO3溶液,该小组用8molL-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括________、_____mL量筒、烧杯、________、胶头滴管等。
②该实验中需要量取8molL-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取用8molL-1的HNO3溶液溶液时仰视量筒刻度线
B.量取用的量筒水洗后未进行任何操作
C.8molL-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称为保险粉,常作还原剂,能溶于冷水,难溶于乙醇,在碱性介质中稳定。
Ⅰ.用甲酸钠(HCOONa)生产保险粉的工艺流程如图:
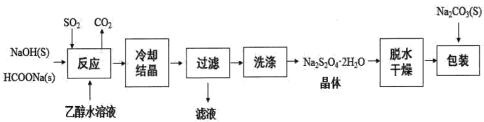
回答下列问题:
(1)Na2S2O4中硫元素的化合价为_____________。
(2)“滤液”中可以循环利用的物质是__________。
(3)“洗涤”所用试剂最好为_________ (填序号)。
a.冰水 b.热水 c.无水乙醇 d.90%乙醇水溶液
(4)“反应”在70℃条件下进行,写出发生反应的化学方程式_______。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_______。
Ⅱ.探究保险粉的性质
(6)现将0.05mol·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:
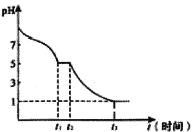
①t1时溶液中含硫元素的粒子浓度由大到小的顺序___________________。
②t2→t3段发生反应的离子方程式为_______________。
(7)取少量连二亚硫酸钠在隔绝空气的条件下加强热使其完全分解,得到Na2SO3、Na2S2O3和一种气体(STP),该反应中氧化产物、还原产物的物质的量之比为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com