
【题目】下列离子方程式正确的是 ( )
A.Na与H2O反应:Na+H2O=Na++OH-+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
D.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
【答案】C
【解析】
A. H原子不守恒,Na与H2O反应正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B. 向Ca(HCO3)2溶液中加入足量的NaOH溶液的正确的离子方程式为:Ca2++2HCO![]() +2OH-=CaCO3↓+2H2O + CO
+2OH-=CaCO3↓+2H2O + CO![]() ,故B错误;
,故B错误;
C. 向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水,由于Cl2先氧化I-,再氧化Fe2+,0.4molI-完全消耗、0.25mol氯气全部消耗,只消耗0.1molFe2+,故正确的离子方程式为:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-,故C正确;
D. 电解MgCl2溶液,由于Mg2+与电解产生的OH-生成Mg(OH)2沉淀,故正确的离子方程式为:Mg2++2H2O+2Cl-![]() Mg(OH)2↓+H2↑+Cl2↑,故D错误;
Mg(OH)2↓+H2↑+Cl2↑,故D错误;
故答案为:C。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
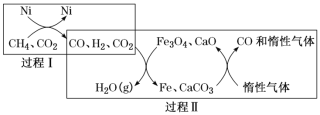
①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;
过程I的热化学方程式为_______。
②关于上述过程II的说法不正确的是______(填字母)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2H2O(g)+CO c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
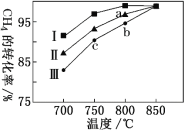
③其他条件不变,在不同催化剂(I、II、III)作用下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点是否达到平衡状态?________(填“是”或“否”);b点CH4的转化率高于c点,原因是________。
(2)在刚性密闭容器中,加入CH4和CO2,二者分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1123 K使其发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4) ·p(CO2)。(单位忽略),某时刻测得p(CO)=20 kPa,则p(CO2)=________kPa,v(CO)=________(单位忽略)。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________。(用各物质的分压计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的H3PO4溶液中,含有0.1NA个H+
D. 10 g的D2O中含有的质子数与中子数分别为5NA和4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。主要实验装置(回流搅拌装置)如图所示:
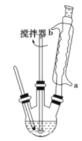
反应原理:
![]() +2KMnO4→
+2KMnO4→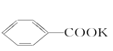 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
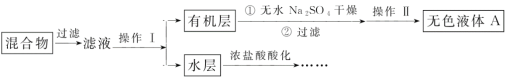
(1)无色液体A的结构简式为___,操作Ⅱ为___;
(2)如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是___,写出该反应的离子方程式:___;
(3)冷却水应该从冷凝管___(填“a”或“b”)口流入;
(4)要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(5)纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是
A.导致易拉罐变瘪的离子反应是CO2+OH﹣=![]()
B.导致易拉罐又鼓起来的反应是Al3++3![]() =Al(OH)3+3CO2↑
=Al(OH)3+3CO2↑
C.上述过程中共发生了三个化学反应,且反应结束后的溶液中n(Na+)不变
D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
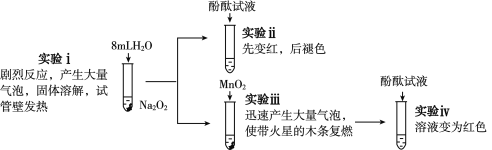
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(83号元素)主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 杂质)为原料提Bi的工艺流程如下:
杂质)为原料提Bi的工艺流程如下:
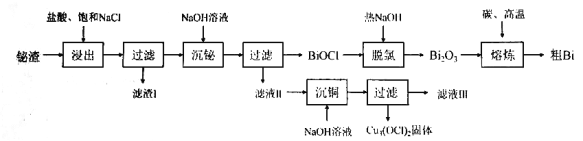
已知:Ⅰ.![]() 不溶于水,加热至700℃就分解生成
不溶于水,加热至700℃就分解生成![]() ,
,![]() 的沸点为447℃。
的沸点为447℃。
Ⅱ.25℃时,![]() ;
;![]() 。
。
回答下列问题:
(1)铋在元素周期表中的位置为___________________。
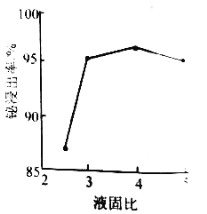
(2)“浸出”时,在盐酸浓度![]() 、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
(3)“滤渣Ⅰ”的成分为_____________(填化学式)。
(4)“脱氯”的化学方程式为___________________。
(5)“沉铜”时,向“滤液Ⅱ”中加入NaOH溶液调节pH,促进![]() 水解生成
水解生成![]() ,则此过程中
,则此过程中![]() 水解的离子方程式为_________________________。若“滤液Ⅱ”中
水解的离子方程式为_________________________。若“滤液Ⅱ”中![]() 为
为![]() ,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀
,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀![]() ,此时
,此时![]() 的去除率为________(忽略溶液体积变化)。
的去除率为________(忽略溶液体积变化)。
(6)“滤液Ⅲ”经加热浓缩后可返回____________工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,现有pH=2的HCl溶液100mL,要使它的pH=3,如果加入蒸馏水,需加水______________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液_____________mL。(假定溶液体积有加和性,下同)
(2)25℃时,将pH=8的NaOH溶液与pH=13的NaOH溶液等体积混合后,溶液的pH=________________。(lg2=0.3)
(3)25℃时,将0.1mol·L-1盐酸和0.06mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=___________。
(4)25℃时,pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.自发进行的反应一定能迅速进行
C.CaCO3(s)![]() CaO(s)+CO2(g)△H>0能否自发进行与温度有关
CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com