
【题目】用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是
A.导致易拉罐变瘪的离子反应是CO2+OH﹣=![]()
B.导致易拉罐又鼓起来的反应是Al3++3![]() =Al(OH)3+3CO2↑
=Al(OH)3+3CO2↑
C.上述过程中共发生了三个化学反应,且反应结束后的溶液中n(Na+)不变
D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
【答案】C
【解析】
根据题意知,该过程发生的反应为: CO2+2NaOH=Na2CO3+H2O、2A1+2NaOH+2H2O=2NaA1O2+3H2↑,Al2O3+2NaOH=2NaA1O2+H2O;
A、由于氢氧化钠溶液过量,导致易拉罐变瘪的离子反应是: CO2+2OH-=CO32-+H2O,选项A错误;
B、导致易拉罐又鼓起来的反应是: 2A1+2NaOH+2H2O=2NaA1O2+3H2↑,选项B错误;
C. 上述过程中总共发生了三个化学反应,且反应过程中钠离子不参与离子反应,结束后的的溶液中n(Na+)不变,选项C正确;
D、若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现变瘪,由于没有气体产生,所以易拉罐不会鼓起,选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】白磷在过量氢氧化钾溶液中可以发生反应:P4+3KOH+3H2O = PH3↑+3KH2PO2。若用NA表示阿伏加德罗常数的值。下列说法错误的是
A.3.1 g白磷所含共价键的数目为0.15NA
B.KH2PO2为正盐,且10.4 g该固体物质中含离子数目为0.2NA
C.2.8 g KOH参加反应转移的电子数为0.05NA
D.室温下,10 mL pH=11的KOH溶液稀释100倍,水电离出的OH-的数目约为10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程,请回答下列问题:
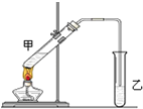
(1)浓硫酸的作用是:①__________②______________;
(2)饱和碳酸钠溶液的主要作用是________________;
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是____;
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____;
(5)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是____;
(6)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是____;
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态,下列描述能说明该反应已达到化学平衡状态的是(填序号)____。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
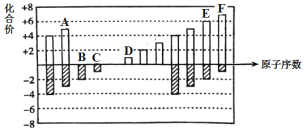
(1)元素F在周期表中的位置是 ______。
(2)元素C、D、E原子半径由大到小的顺序是 ______(填元素符号)。
(3)A、B、C的单质与氢气反应的剧烈程度由强到弱的顺序_____(用单质的化学式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式______、__(写2种)。
(5)根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 _____(填“能”或“不能”), 若能则写出反应的化学方程式 ______。
(6)一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) ![]() 2AB2(g)。可以作为达到平衡状态的标志是 ______。
2AB2(g)。可以作为达到平衡状态的标志是 ______。
A. 单位时间内生成nmolB2的同时生成2nmolAB B. 2 ν正(B2)=ν逆(AB2)
C. 混合气体的颜色不再改变(AB2为有色气体) D. 混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2=2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓
D.C+H2O![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.Na与H2O反应:Na+H2O=Na++OH-+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
D.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌原子的价电子排布图:____________________________________________
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是________________
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含___________mol σ键。该配离子中三种元素的电负性大小关系是:_______________________
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为________
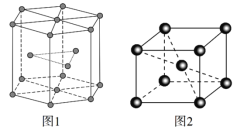
(5)锆晶胞如图1所示,这种堆积方式称为______________________,镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB- ![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”)。理由是______(用离子方程式表示)。
(2)若0.1mol·L-1的NaHB溶液PH=2,则0.1mol/LH2B溶液中氢离子浓度可能是_________0.11mol/L(填“﹥”“=” 或“﹤”) ,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)![]() xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(Lmin),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com