
����Ŀ��������Ȩ�������Ȼ������������ҹ���ѧ��ѡ���ڻ�ﯣ�ZrTe2�����黯�ӣ�Cd3As2��Ϊ������֤����ά���ӻ���ЧӦ���������˽���-��Ե���ת�����ش��������⣺
(1)пԭ�ӵļ۵����Ų�ͼ��____________________________________________
(2)�����λ��ͬ���壬H2S�ķֽ��¶ȸ���H2Te������Ҫԭ����________________
(3)Cd2+��NH3�������γ������ӡ�1 mol [Cd(NH3)4]2+��___________mol ��������������������Ԫ�صĵ縺�Դ�С��ϵ�ǣ�_______________________
(4)����±���γɶ���±���AsCl3��AsF3��AsBr3���۵��ɸߵ��͵�����Ϊ________
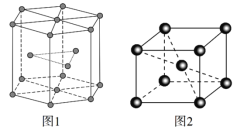
(5)ﯾ�����ͼ1��ʾ�����ֶѻ���ʽ��Ϊ______________________���Ӿ�����ͼ2��ʾ����֪��NA�ǰ����ӵ�������ֵ�������ܶ�Ϊd g��cm3���ڸþ�����������ԭ������˼��Ϊ______nm���ú�NA��d�Ĵ���ʽ��ʾ�����Ӿ�����ԭ�ӿռ�������Ϊ________���ú����Ĵ���ʽ��ʾ����
���𰸡�![]() Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ� 16 N>H>Cd AsBr3>AsCl3>AsF3 �������ܶѻ�
Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ� 16 N>H>Cd AsBr3>AsCl3>AsF3 �������ܶѻ� ![]()
![]()
��������
(1)п��30��Ԫ�أ���ԭ�ӵļ۵����Ų�ͼ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�����λ��ͬ���壬ͬһ�����������Ԫ�ص�ԭ�Ӱ뾶����������̬�⻯��H2S�еĹ��ۼ�������H2Te�ļ������̣�һ�����Խ�̣�����Խ��ѧ����Խ�ȶ�������H2S�ķֽ��¶ȸ���H2Te���ʴ�Ϊ��Sԭ�Ӱ뾶С��Te��H��S���ļ��ܽϴ�
(3)Cd2+��NH3�������γ������ӡ�1 mol [Cd(NH3)4]2+�к��е� ������ĿΪ4��������ÿ��������������������ÿ����������Cd2+�γ�1����λ��Ҳ���������������![]() mol����������������Ԫ�طֱ�ΪCd��N��H�ĵ縺�Դ�С��ϵΪN>H>Cd���ʴ�Ϊ��16�� N>H>Cd��
mol����������������Ԫ�طֱ�ΪCd��N��H�ĵ縺�Դ�С��ϵΪN>H>Cd���ʴ�Ϊ��16�� N>H>Cd��
(4)����±���γɶ���±���AsCl3��AsF3��AsBr3��Ϊ���ۻ������Ϊ���Ӿ��壬���۵�ĸߵ���Ҫ���ܷ��Ӽ�������Ӱ�죬���ڽṹ���Ƶķ��Ӿ��壬���Ӽ�������������Է������������ȣ��ʴ�Ϊ��AsBr3>AsCl3>AsF3��
(5)ﯾ�����ͼ1��ʾ�����������������ѻ��������ֶѻ���ʽ��Ϊ���������ѻ����Ӿ�����ͼ2��ʾ��1�������к��е���ԭ����ĿΪ��![]() �����辧���ı߳�Ϊacm�����У�
�����辧���ı߳�Ϊacm�����У�![]() ���Ӷ��Ƴ���
���Ӷ��Ƴ��� ���þ�����������ԭ������˼��Ϊ��Խ��ߵ�һ�뼴��
���þ�����������ԭ������˼��Ϊ��Խ��ߵ�һ�뼴��![]() nm���Ӿ�������2����ԭ�ӣ������֮��Ϊ��
nm���Ӿ�������2����ԭ�ӣ������֮��Ϊ��![]() ��������������Ϊ��
��������������Ϊ��![]() ���������������У�
���������������У�![]() ���ռ�������Ϊ��
���ռ�������Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() nm
nm ![]() ��
��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������γɵĻ���������࣬�ճ�������Ӧ�ù㷺�������������(Na2S2O3)����Ϊ����ҵ�Ķ�Ӱ������Ӧ�Ļ�ѧ����ʽ���£�AgBr��2Na2S2O3===Na3[Ag(S2O3)2]��NaBr���ش��������⣺
(1)��̬S�ļ۵����Ų�ͼΪ____________��
(2)���й������ʽṹ�����ʵ�˵������ȷ����________��
A������ԭ�ӽṹģ���ܹ��ɹ��ؽ�����ԭ�ӹ���
B��Br��S��O����Ԫ�صĵ縺��˳��Ϊ O��Br��S
C��Na�ĵ�һ������С�� Mg������ڶ�������ȴԶ���� Mg
D��ˮ���Ӽ�����������H2O���۷е㼰�ȶ��Ծ�����H2S
(3)����VSEPR�����Ʋ�![]() �Ŀռ乹��Ϊ______������ԭ��S���ӻ���ʽΪ________��[Ag(S2O3)2]3-�д��ڵĻ�ѧ����________(����ĸ)��
�Ŀռ乹��Ϊ______������ԭ��S���ӻ���ʽΪ________��[Ag(S2O3)2]3-�д��ڵĻ�ѧ����________(����ĸ)��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D�������� E����λ��
(4)��һ��������(E1)��ָԪ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų�������(��λΪkJ��mol-1)����������Խ��Ԫ��ԭ��Խ�õ��ӡ���֪�������ڲ���Ԫ�ص�һ�����������±���
Ԫ�� | Al | Si | P | S | Cl |
E1/(kJ��mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
����Ԫ�ص�E1������ҳ��������ƣ��Է���PԪ�س����쳣��ԭ��___________��
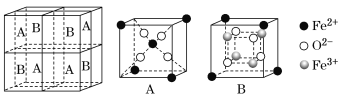
(5)ij�����������������ᄃ����ͼ��ʾ������A��B��ɡ����������Ļ�ѧʽΪ_____����֪�þ���ľ�������Ϊa nm�������ӵ�������ֵΪNA�����ܶ���Ϊ______g��cm-3(�ú�a��NA �Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��ɫ��ΪʹʳƷ��ɫ�����ʣ������Ӷ�ʳƷ���Ⱥü��̼�ʳ��������ء��������dz������ǹ���ѩ���ʳƷ����ɫ������Ҫ�ɷ֣��ṹ����ͼ��ʾ��
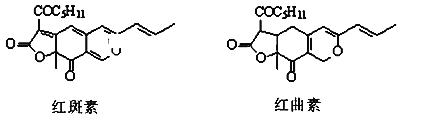
����˵����ȷ����
A.����غͺ����ض�����2������̼ԭ��
B.����غͺ����� ����ͬ���칹��
C.������к����Ѽ����ʻ������������ֺ���������
D.1 mol�������������6 mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ռ���CO2���������NaOHŨ��Һ�������ѿڷ�գ����������������������첢����ˣ�����һ������������ֻ����첢������������˵����ȷ����
A.���������ޱ������ӷ�Ӧ��CO2+OH����![]()
B.�����������ֹ������ķ�Ӧ��Al3++3![]() ��Al��OH��3+3CO2��
��Al��OH��3+3CO2��
C.���������й�������������ѧ��Ӧ���ҷ�Ӧ���������Һ��n(Na+)����
D.����CO2��ΪNH3��ŨNaOH��Һ��Ϊˮ��������Ҳ������ȱ��ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һӦ��ǰ�����������ײ��ϼף�����A��B���ֶ����ڷǽ���Ԫ����ɣ�������ˮ����Ӳ�ȴ��۵�ߡ�ȡ���ϼ������ڵ��ռӦ������һ�ֺ�AԪ�صĺ��������Һ�һ�ֺ�BԪ�ص������������ʹʪ��ĺ�ɫʯ����ֽ��������������ˮ�������������ɫ��������������������ܽ⡣
��1���Ļ�ѧʽΪ_________���侧������________����
��2���ҵ�ˮ��Һ����������__________________��д��һ����;��
��3��BԪ�ص�һ���⻯�ﶡ����Է�������Ϊ32��������ΪҺ�壬��ȼ�շ��ȶ���ȼ�ղ���Ի�������Ⱦ����˿��������ȼ�ϡ�ȼ�ϵ��ȼ�ϵȡ��ĵ���ʽΪ_____________��
��ijͭ��Ʒ�ڳ�ʪ�����з����ĵ绯ѧ��ʴ���̿ɱ�ʾΪ��ͼ����ʴ����A�������ɣ�ijС��Ϊ����A���ʵ���ɣ�����������ʵ�飺
ʵ��٣�ȡA��Ʒ���ӹ���ϡ������ȫ�ܽ���ټ���AgNO3��Һ���а�ɫ�������ɡ�
ʵ��ڣ���ȡA��Ʒ4.29g�����뺬![]() ��ϡ������Һ��ǡ���кͣ����������εĻ����Һ�������û����Һ�м���������NaOH��Һ��������ɫ�����������ˡ�ϴ�ӡ����յ�3.20g��ɫ���塣
��ϡ������Һ��ǡ���кͣ����������εĻ����Һ�������û����Һ�м���������NaOH��Һ��������ɫ�����������ˡ�ϴ�ӡ����յ�3.20g��ɫ���塣
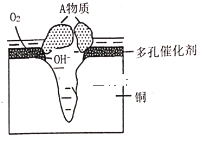
��1���÷�״���г���ͭԪ������У�дԪ�ط��ţ�_____Ԫ��.
��2��д���÷�״������ϡ���ᷴӦ�����ӷ���ʽ____��
��3�����������£�ʵ��������õĺ�ɫ���������Ҵ���Ӧ����ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
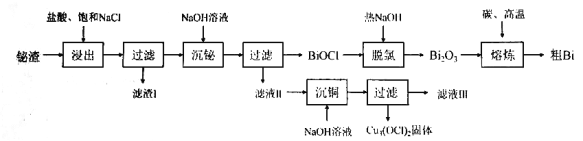
����Ŀ���飨83��Ԫ�أ���Ҫ��������Ͻ���Ͻ��������ʱ�����������ԣ���������ӡˢǦ�ֺ߾������͡�ʪ�������¹�����������������Ҫ�ɷ�Ϊ![]() ������
������![]() ��
��![]() ��
��![]() ���ʣ�Ϊԭ����Bi�Ĺ����������£�
���ʣ�Ϊԭ����Bi�Ĺ����������£�
��֪����.![]() ������ˮ��������700���ͷֽ�����
������ˮ��������700���ͷֽ�����![]() ��
��![]() �ķе�Ϊ447����
�ķе�Ϊ447����
��.25��ʱ��![]() ��
��![]() ��
��
�ش��������⣺
��1������Ԫ�����ڱ��е�λ��Ϊ___________________��
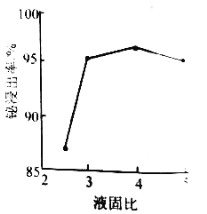
��2����������ʱ��������Ũ��![]() �������¶�70��������ʱ��2h����ͬ����Һ�̱������½��н���ʵ�飬��������Һ�̱ȵĹ�ϵ��ͼ��ʾ������ʵ�Һ�̱�Ӧѡ__________��
�������¶�70��������ʱ��2h����ͬ����Һ�̱������½��н���ʵ�飬��������Һ�̱ȵĹ�ϵ��ͼ��ʾ������ʵ�Һ�̱�Ӧѡ__________��
��3�����������ijɷ�Ϊ_____________���ѧʽ����
��4�����������Ļ�ѧ����ʽΪ___________________��
��5������ͭ��ʱ��������Һ���м���NaOH��Һ����pH���ٽ�![]() ˮ������
ˮ������![]() ����˹�����
����˹�����![]() ˮ������ӷ���ʽΪ_________________________��������Һ����
ˮ������ӷ���ʽΪ_________________________��������Һ����![]() Ϊ
Ϊ![]() ��������������NaOH��Һʱ��pHǡ��Ϊ6�����ֳ���
��������������NaOH��Һʱ��pHǡ��Ϊ6�����ֳ���![]() ����ʱ
����ʱ![]() ��ȥ����Ϊ________��������Һ����仯����
��ȥ����Ϊ________��������Һ����仯����
��6������Һ��������Ũ����ɷ���____________����ѭ��ʹ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ӷ���ʽ�У�����ˮ�ⷴӦ����
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,��������AgCl�ֱ��������������,AgCl���ܽ���ɴ�С������˳����
��20 mL 0.01 mol/L KCl��Һ ��30 mL 0.02 mol/L CaCl2��Һ
��40 mL 0.03 mol/L HCl��Һ ��10 mL ����ˮ��50 mL 0.05 mol/L AgNO3��Һ
A. ������������������ B. ������������������
C. ������������������ D. ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com