
【题目】Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________,其晶体属于________晶体
(2)乙的水溶液可以用来做__________________(写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________。
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
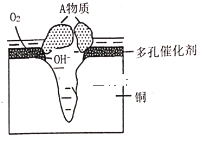
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____。
【答案】Si3N4 原子 黏合剂、木材等的防腐剂或防火剂 ![]() O、H、Cl
O、H、Cl ![]()
![]()
【解析】
Ⅰ、材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一-种含B元素的气体丙,且能使湿润的红色石蕊试纸变蓝,证明丙气体为NH3,说明甲中含有氮元素;含氧酸盐乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解,说明生成的沉淀为H2SiO3,证明甲中含有硅元素,材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高,证明是一种原子晶体含有氮元素和硅元素,依据元素化合价熟悉得到甲为Si3N4,判断乙为硅酸钠,A为硅元素,B为氮元素;
Ⅰ、(1)分析推断甲为氮化硅,化学式为Si3N4,分析性质判断为原子晶体;故答案为:Si3N4,原子晶体;
(2)乙的水溶液为硅酸钠水溶液,俗称为水玻璃,是一种矿物胶,可以做黏合剂、木材等的防腐剂或防火剂;故答案为:黏合剂、木材等的防腐剂或防火剂;
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,由题意可知丁为N2H4,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ(1)、根据先加入稀硝酸完全溶解后,再加硝酸银,产生白色沉淀,推出含有Cl元素;再根据另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液,推出含有氢氧离子,所以含有H、O元素,故答案为O、H、Cl;
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液,推出含有氢氧离子,所以含有H、O元素,故答案为O、H、Cl;
(2)、根据实验②灼烧得到3.2g的黑色固体为氧化铜,物质的量为0.04mol,则铜元素的物质的量为0.04mol,加![]() 恰好中和推知氢氧根的物质的量为0.06mol,再根据化合价推知氯元素的物质的量为0.02mol,所以粉末锈的化学式为Cu2(OH)3Cl,所以粉状锈溶于稀硫酸反应的离子方程式为:
恰好中和推知氢氧根的物质的量为0.06mol,再根据化合价推知氯元素的物质的量为0.02mol,所以粉末锈的化学式为Cu2(OH)3Cl,所以粉状锈溶于稀硫酸反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)、加热条件下,黑色固体氧化铜与乙醇反应化学方程式为:![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,要将样品中有机氮转化成铵盐。能证明铵根存在的离子方程式是__。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。
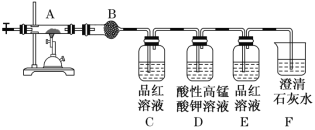
①装置B中的试剂是________。
②装置D的作用是_______。
③当装置B、C、E、F依次出现下列现象:_____,品红溶液褪色,_____,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘,已知:2![]() +I2===
+I2===![]() +2I-。
+2I-。
(3)写出二氧化硫与碘水反应的化学方程式:_______。
(4)达到滴定终点的标志为________。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2 mL。该蛋白质中的硫元素的质量分数为______。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,下列说法错误的是( )
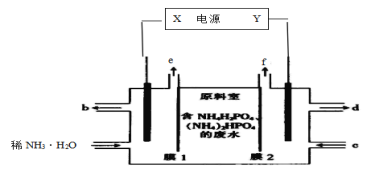
A.电源中X和Y两电极的电势X比Y低
B.膜1为阳离子交换膜,f口放出的是O2
C.阳极区反应之一为:2H2O-4e-+2HPO![]() =O2↑+2H3PO4
=O2↑+2H3PO4
D.每放出11.2L(标准状况下)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A.2NaBr+Cl2=2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓
D.C+H2O![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 mol N4(分子为正四面体结构)含共价键数目为2NA
B.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
C.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌原子的价电子排布图:____________________________________________
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是________________
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含___________mol σ键。该配离子中三种元素的电负性大小关系是:_______________________
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为________
(5)锆晶胞如图1所示,这种堆积方式称为______________________,镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
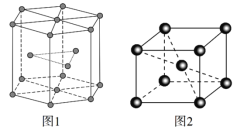
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.只用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯
B. 的二氯代物共有6种(不考虑立体异构)
的二氯代物共有6种(不考虑立体异构)
C.![]() 的名称为2-甲基-2-乙基-1-丁醇
的名称为2-甲基-2-乙基-1-丁醇
D.碳酸亚乙酯(![]() )可与热的
)可与热的![]() 溶液反应
溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mL pH=11的氨水加水稀释至100mL,下列判断正确的是( )
A.稀释后溶液的pH=10
B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大
增大
D.pH=11氨水的浓度为0.001mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
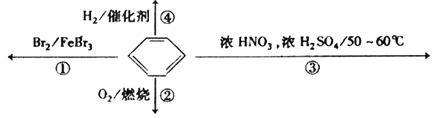
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com