
【题目】25℃时将10mL pH=11的氨水加水稀释至100mL,下列判断正确的是( )
A.稀释后溶液的pH=10
B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大
增大
D.pH=11氨水的浓度为0.001mol·L-1
【答案】C
【解析】
A.一水合氨是弱电解质,在水溶液里部分电离,加水促进电离,将10mLpH=11的氨水加水稀释至100mL,体积增大10倍,pH变化小于1个单位,即稀释后10<pH<11,故A错误;
B.加水稀释促进一水合氨电离,溶液中c(OH﹣)减小,温度不变,则水的离子积常数不变,则溶液中c(H+)增大,故B错误;
C.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3.H2O)减小,在同一溶液中,V相同,则溶液中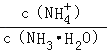 增大,故C正确;
增大,故C正确;
D.一水合氨是弱电解质,在水溶液里部分电离,则溶液中氨水浓度大于氢氧根离子的浓度,则pH=11氨水中的c(OH-)=10-3mol/L,所以氨水的浓度大于0.001mol/L,故D错误;
故答案选C。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷的制备原理是:CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2—CH2Br;某课题小组用下图所示的装置制备1,2-二溴乙烷。
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2—CH2Br;某课题小组用下图所示的装置制备1,2-二溴乙烷。

回答下列问题:
(1)装置B的作用是_______。
(2)三颈烧瓶内加入一定量的乙醇-浓硫酸混合液和少量粗砂,其加入粗砂目的是_______,仪器E的名称是_______。
(3)装置C内发生的主要反应的离子方程式为_______。
(4)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A内反应温度升温至160~180℃,从滴液漏斗中慢慢滴加乙醇-浓硫酸混合液,保持乙烯气体均匀地通入装有3.20mL液溴(ρ液溴=3g/cm3)和3mL水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_______
②判断反应结束的现象是_______
(5)将粗品移入分液漏斗,分别用水、氢氧化钠溶液、水洗涤,产品用无水氯化钙干燥,过滤后蒸馏收集129~133℃馏分,得到7.896g1,2-二溴乙烷。1,2-二溴乙烷的产率为_______。
(6)下列操作中,不会导致产物产率降低的是(填正确答案的标号)_______.
a.乙烯通入溴水时速率太快 b.装置E中的NaOH溶液用水代替.
c.去掉装置D烧杯中的水 d.实验时没有C装置
e.D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为_________,其晶体属于________晶体
(2)乙的水溶液可以用来做__________________(写出一种用途)
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则丁的电子式为_____________。
Ⅱ.某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入AgNO3溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
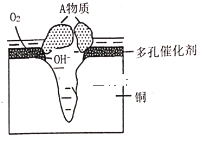
(1)该粉状锈中除了铜元素外还含有(写元素符号)_____元素.
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2O2__________(填“是”或“否”)属于碱性氧化物,Na2O2是______色固体粉末。向包有Na2O2固体的棉花上滴几滴水,棉花很快燃烧起来,原因是该反应有氧气生成且该反应为__________(填”吸热”或者“放热”)反应;
(2)Na2O2作为在潜水艇和消防员呼吸面具中的供氧剂,写出其中一个反应的化学方程式_________,某潜水艇中有50人,若每人每小时消耗O2在标准状况下的体积为44.8L,假设所需要的O2全由Na2O2所提供,则每小时所需Na2O2的质量为________Kg。
(3)3.1gNa2O溶于水配成1L溶液,溶液中Na+离子物质的量浓度为________
(4)制备Fe(OH)3胶体:用洁净的烧杯取一定量蒸馏水,用酒精灯加热至沸腾,向烧杯中加入几滴饱和FeCl3溶液继续加热至液体呈透明的红褐色。
①写出制备Fe(OH)3胶体反应的离子方程式______________________________
②验证制得的分散系是胶体的方法为_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用干燥的HCl气体和铁粉在加热无氧条件下制备无水![]() ,装置如图所示,热电偶的作用是测定电炉内的温度。
,装置如图所示,热电偶的作用是测定电炉内的温度。

下列说法错误的是( )
A.该方法的优点是制备的![]() 纯净
纯净
B.由实验可以推出![]() 的沸点低于铁粉的沸点
的沸点低于铁粉的沸点
C.本实验制备1 mol ![]() 需要通入2 mol HCl气体
需要通入2 mol HCl气体
D.纯净![]() 能够被干燥的氧气氧化为
能够被干燥的氧气氧化为![]() ,同时有
,同时有![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2 s时测得C的浓度为0.6 mol·L-1,填写下列空白:
(1)用物质A表示反应的平均速率为_________。
(2)用物质B表示反应的平均速率为_________。
(3)2 s时物质A的转化率为_________。
(4)2 s时物质B的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是
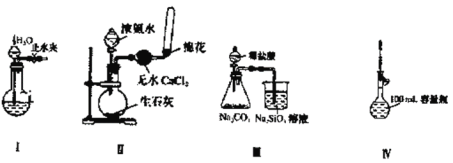
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:制取收集氨气
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com