
【题目】实验室用干燥的HCl气体和铁粉在加热无氧条件下制备无水![]() ,装置如图所示,热电偶的作用是测定电炉内的温度。
,装置如图所示,热电偶的作用是测定电炉内的温度。

下列说法错误的是( )
A.该方法的优点是制备的![]() 纯净
纯净
B.由实验可以推出![]() 的沸点低于铁粉的沸点
的沸点低于铁粉的沸点
C.本实验制备1 mol ![]() 需要通入2 mol HCl气体
需要通入2 mol HCl气体
D.纯净![]() 能够被干燥的氧气氧化为
能够被干燥的氧气氧化为![]() ,同时有
,同时有![]() 生成
生成
【答案】C
【解析】
根据题干信息,结合实验装置分析可得,本实验的主要操作为向装有铁粉的硬质玻璃管中通入HCl,使用电炉加热制取无水FeCl2,一定温度下FeCl2升华,进入氯化亚铁承接器中,从而得到纯净的无水FeCl2,据此分析解答问题。
A.该反应是用干燥的HCl气体和铁粉在加热无氧条件下制备FeCl2,一定温度下FeCl2升华,进入氯化亚铁承接器中,不会混有铁粉,得到的FeCl2纯净,A选项正确;
B.由实验可知,相同温度下FeCl2升华,进入氯化亚铁承接器中,而铁粉滞留于硬质玻璃管中,故FeCl2的沸点低于铁粉的沸点,B选项正确;
C.本实验的制备原理为:Fe+2HCl===FeCl2+H2,制备1molFeCl2时需要2molHCl参与反应,但在反应之前需要先通入HCl气体排尽装置内的空气,故所需要通入的HCl气体应大于2mol,C选项错误;
D.纯净FeCl2具有还原性,能够被干燥的O2氧化为FeCl3,同时会生成Fe2O3,D选项正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,下列说法错误的是( )
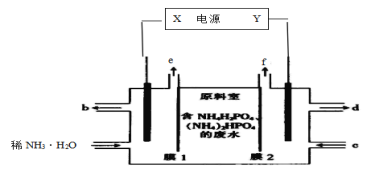
A.电源中X和Y两电极的电势X比Y低
B.膜1为阳离子交换膜,f口放出的是O2
C.阳极区反应之一为:2H2O-4e-+2HPO![]() =O2↑+2H3PO4
=O2↑+2H3PO4
D.每放出11.2L(标准状况下)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.只用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯
B. 的二氯代物共有6种(不考虑立体异构)
的二氯代物共有6种(不考虑立体异构)
C.![]() 的名称为2-甲基-2-乙基-1-丁醇
的名称为2-甲基-2-乙基-1-丁醇
D.碳酸亚乙酯(![]() )可与热的
)可与热的![]() 溶液反应
溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mL pH=11的氨水加水稀释至100mL,下列判断正确的是( )
A.稀释后溶液的pH=10
B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大
增大
D.pH=11氨水的浓度为0.001mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2![]() HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
A. 储氢、释氢过程均无能量变化
B. NaHCO3、HCOONa均含有离子键和共价键
C. 储氢过程中,NaHCO3被氧化
D. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研工作者研制出基于PANa(聚丙烯酸钠)电解质的![]() 可充电电池,该电池具有高容量和超长循环稳定性。电池反应为
可充电电池,该电池具有高容量和超长循环稳定性。电池反应为![]()
![]()
![]()
![]()
![]() 。PANa是一种超强吸水聚合物,吸收大量
。PANa是一种超强吸水聚合物,吸收大量![]() 和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如下。下列说法错误的是( )
和KOH溶液作为水和离子含量调节剂形成水凝胶电解质,示意图如下。下列说法错误的是( )
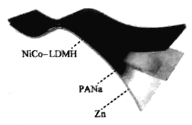
A.PANa是一种有机高分子聚合物,在水溶液中不会发生电离
B.PANa具有超强吸水性可避免电池充放电过程中因失水使离子导电率下降
C.放电时,负极附近pH减小
D.充电时,阳极反应为![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在配制AlCl3溶液时,Al3+会部分水解而使溶液呈酸性,水解的离子方程式为___;为了防止发生水解,可以加入少量的___;溶液加热蒸发灼烧得到固体___。
(2)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=__mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是___mol·L-1。
(3)泡沫灭火剂包括Al2(SO4)3溶液、NaHCO3溶液及起泡剂,使用时发生的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
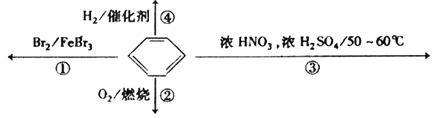
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
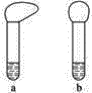
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com