
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
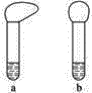
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
【答案】Al Mg+2H+=Mg2++H2↑ (1)
【解析】
(1)比较镁、铝的金属性强弱,根据与同浓度的稀盐酸反应时放出气体的快慢,依据实验现象,判断金属性的强弱;
(2)根据离子方程式,物质的量相等的Mg、Al,计算出氢气的物质的量,参照实验现象,判断出金属的种类;
(3)比较金属性强弱的方法看的是剧烈程度,而不是产生气体的多少;
(1)反应初始时观察到a试管上的气球体积大,则说明与同浓度的稀盐酸反应时a试管中的金属反应速率快,反应速率快的金属性强,所以试管中是Al与盐酸反应,即试管b内加入的金属为Al;
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球a中生成的气体多,Mg、Al分别与稀盐酸反应的离子方程式为:Mg+2H+=Mg2++ H2↑、2Al+6H+=2A13+ +3H2↑根据离子方程式可知,物质的量相等的Mg、Al与足量的盐酸反应时Al生成的氢气多,则a中为Al与盐酸反应,所以试管b中反应的离子方程式为:Mg+2H+=Mg2++ H2↑;
(3)与同浓度的稀盐酸反应速率越快,则金属性越强金属与盐酸反应生成氢气的多少不能证明金属性的强弱,所以实验( 1 )能证明镁的金属性强于铝;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用干燥的HCl气体和铁粉在加热无氧条件下制备无水![]() ,装置如图所示,热电偶的作用是测定电炉内的温度。
,装置如图所示,热电偶的作用是测定电炉内的温度。

下列说法错误的是( )
A.该方法的优点是制备的![]() 纯净
纯净
B.由实验可以推出![]() 的沸点低于铁粉的沸点
的沸点低于铁粉的沸点
C.本实验制备1 mol ![]() 需要通入2 mol HCl气体
需要通入2 mol HCl气体
D.纯净![]() 能够被干燥的氧气氧化为
能够被干燥的氧气氧化为![]() ,同时有
,同时有![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是
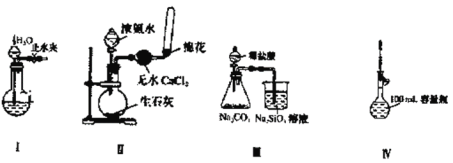
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:制取收集氨气
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)画出下列卤族元素的原子结构示意图:①氟________;②氯________③溴________;④碘_________。
(2)比较卤族元素的原子结构:
①它们在结构上的相同点是____________;
②它们在结构上的不同点是_____________。
(3)卤族元素原子结构的变化规律是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
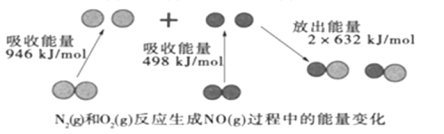
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,1L恒容密闭容器中发生如下反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g),该反应的平衡常数K=0.5,下列说法正确的是
Fe(s)+CO2(g),该反应的平衡常数K=0.5,下列说法正确的是
A.加入炭粉对该平衡无影响
B.将FeO(s)粉碎,不能缩短到达平衡所需的时间
C.t℃时,反应达到平衡后再充入CO,达新平衡后 n(CO):n(CO2)比值增大
D.若该容器中加入1molFeO(s),并通入1.8molCO, t℃时反应达到平衡,此时FeO(s)转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构或性质的描述,不正确的是( )
A. C4H9OH发生催化氧化反应,可生成3种有机产物
B. 光照下,Cl2可在甲苯的苯环上发生取代反应
C. 乙二醇和乙二酸可发生缩聚反应,生成高分子化合物
D. 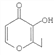 的分子式为C7H8O3
的分子式为C7H8O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com