
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB- ![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”)。理由是______(用离子方程式表示)。
(2)若0.1mol·L-1的NaHB溶液PH=2,则0.1mol/LH2B溶液中氢离子浓度可能是_________0.11mol/L(填“﹥”“=” 或“﹤”) ,理由是__________。
【答案】碱性 B2-+H2O≒HB-+OH- < 第一步电离产生的H+抑制了第二步的电离
【解析】
某二元酸H2B在水溶液中发生电离的方程式为:H2B=H++HB-,HB- ![]() H++B2-。
H++B2-。
从方程式可以看出,H2B第一步发生完全电离,第二步部分发生电离,所以HB-只发生电离,不发生水解。
(1)Na2B溶液中,B2-发生水解,从而使溶液显碱性。答案为:碱
理由是B2-+H2O![]() HB-+OH-。答案为:B2-+H2O
HB-+OH-。答案为:B2-+H2O![]() HB-+OH-
HB-+OH-
(2)因为H2B=H++HB-,所以0.1mol/LH2B溶液中c(H+)=0.1mol·L-1,因为第一步电离产生的H+会对第二步电离产生影响,所以第二步电离产生的c(H+)<0.01mol·L-1,故0.1mol/LH2B溶液中氢离子浓度可能<0.11mol/L。答案为:<
理由是第一步电离产生的H+抑制了第二步的电离
答案为:第一步电离产生的H+抑制了第二步的电离


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是
A.导致易拉罐变瘪的离子反应是CO2+OH﹣=![]()
B.导致易拉罐又鼓起来的反应是Al3++3![]() =Al(OH)3+3CO2↑
=Al(OH)3+3CO2↑
C.上述过程中共发生了三个化学反应,且反应结束后的溶液中n(Na+)不变
D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(83号元素)主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 杂质)为原料提Bi的工艺流程如下:
杂质)为原料提Bi的工艺流程如下:
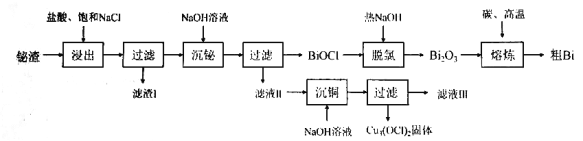
已知:Ⅰ.![]() 不溶于水,加热至700℃就分解生成
不溶于水,加热至700℃就分解生成![]() ,
,![]() 的沸点为447℃。
的沸点为447℃。
Ⅱ.25℃时,![]() ;
;![]() 。
。
回答下列问题:
(1)铋在元素周期表中的位置为___________________。
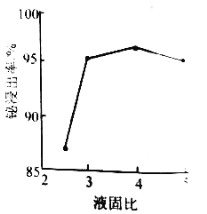
(2)“浸出”时,在盐酸浓度![]() 、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
(3)“滤渣Ⅰ”的成分为_____________(填化学式)。
(4)“脱氯”的化学方程式为___________________。
(5)“沉铜”时,向“滤液Ⅱ”中加入NaOH溶液调节pH,促进![]() 水解生成
水解生成![]() ,则此过程中
,则此过程中![]() 水解的离子方程式为_________________________。若“滤液Ⅱ”中
水解的离子方程式为_________________________。若“滤液Ⅱ”中![]() 为
为![]() ,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀
,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀![]() ,此时
,此时![]() 的去除率为________(忽略溶液体积变化)。
的去除率为________(忽略溶液体积变化)。
(6)“滤液Ⅲ”经加热浓缩后可返回____________工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,现有pH=2的HCl溶液100mL,要使它的pH=3,如果加入蒸馏水,需加水______________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液_____________mL。(假定溶液体积有加和性,下同)
(2)25℃时,将pH=8的NaOH溶液与pH=13的NaOH溶液等体积混合后,溶液的pH=________________。(lg2=0.3)
(3)25℃时,将0.1mol·L-1盐酸和0.06mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=___________。
(4)25℃时,pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对实验室中的一种白色固体进行鉴别,实验探究如下:
①将适量白色固体溶于水,得到无色溶液A,溶液呈碱性;
②用铂丝蘸取少量溶液A在火焰上灼烧,产生黄色火焰;
③取少量溶液A加入酸性高锰酸钾溶液,溶液褪色,继续加入氯化钡溶液生成不溶于硝酸的白色沉淀;
④另取少量溶液A加入硫粉,加热,硫溶解生成无色溶液B,且无其他明显现象;继续向溶液B中加入盐酸,产生淡黄色沉淀和刺激性气味的气体;若将溶液B加入![]() 沉淀中,沉淀溶解。
沉淀中,沉淀溶解。
下列叙述错误的是( )
A.由实验可推测该白色固体为![]() 或
或![]()
B.实验③发生的离子方程式可能为![]()
![]()
C.实验④中生成无色溶液B的化学方程式为:![]()
D.由实验④可知![]() 可以和
可以和![]() 形成配合物
形成配合物![]() 而溶解
而溶解![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com