
����Ŀ����һij�о���ѧϰС���ڻ�ѧʵ������ʱ̽��������ԭ����ͭʵ�飮
��1�����ۼ��㣺��ȡ24.0g CuO����ʵ�飬��H2������Ӧ�ÿ��Եõ�Cu������Ϊ______ g
��2��ʵ�飺��24.0g CuO��ȫ��ɺ�ɫ���壬��ȴ���������ù���20.4g���������������ѧ������Ȥ��
��3��һ��ѧ���������ϣ�
��H2��ԭCuOʱ�����ܵõ�������ͭ��CuO����CuOΪ��ɫ���壬������ˮ��
��Cu2O����ϡ���ᷴӦ��CuO+HSO=CuSO+Cu+HO��
��Cu2O����ϡ���ᷴӦ��3CuO+14HNO��ϡ��=6Cu��NO��+2NO��+7HO��
����Cu����ϡ���ᷴӦ��3Cu+8HNO��ϡ��=3Cu��NO��+2NO��+4HO��
���ۣ�����ѡ��������______������ϡ����������ϡ���������жϺ�ɫ�����л���Cu2O�� ������______��
��4����һ��ѧ����Ϊͨ�����㣬����ȷ�Ϲ���ɷ���Cu��Cu2O�Ļ���20.4g��ɫ������Cu2O�����ʵ���Ϊ______mol����20.4g��ɫ������뵽���Ϊ200mL������ϡ�����У�����ԭ����������ʵ���Ϊ______mol��
���𰸡�19.2 ϡ���� ��Һ����ɫͬʱ�к�ɫ������� 0.075 0.15
��������
(1)����ͭԪ���غ����ͭ��������
(3)������Ϣ���֪��Cu2O����ϡ���ᷴӦ����ͭ������ͭ�����ݢ���֪��Cu2O��Cu������ϡ���ᷴӦ��������ͭ��һ��������
(4)��CuΪxmol��Cu2OΪymol������������![]() ���ɴ�ȷ��Cu2O�����ʵ�������ɫ������뵽������ϡ�����У�ͭ����������+2��ͭ���ӣ�������еĵ���+5�۱���ԭΪ+2�۵�NO�����ݵ��ӵ�ʧ�غ���㱻��ԭ����������ʵ�����
���ɴ�ȷ��Cu2O�����ʵ�������ɫ������뵽������ϡ�����У�ͭ����������+2��ͭ���ӣ�������еĵ���+5�۱���ԭΪ+2�۵�NO�����ݵ��ӵ�ʧ�غ���㱻��ԭ����������ʵ�����
(1)24.0g CuO��ͭԪ�ص�����Ϊ![]() g��19.2g������ͭԪ���غ��֪���Եõ�Cu������Ϊ19.2g��
g��19.2g������ͭԪ���غ��֪���Եõ�Cu������Ϊ19.2g��
(3)������Ϣ���֪��Cu2O����ϡ���ᷴӦ����ͭ������ͭ�����ݢ���֪��Cu2O��Cu������ϡ���ᷴӦ��������ͭ��һ���������������������ж��Ƿ���Cu2O������ѡ��ϡ���ᣬ����Һ����ɫͬʱ�к�ɫ������֣���˵����Cu2O��
(4)��CuΪxmol��Cu2OΪymol������������![]() ��x��0.15mol��y��0.075mol������Cu2O�����ʵ���Ϊ0.075mol����ɫ������뵽������ϡ�����У�ͭ����������+2��ͭ���ӣ�����ת�Ƶ����ʵ���Ϊ0.15mol��2+0.075mol��2��0.45mol��������еĵ���+5�۱���ԭΪ+2�۵�NO�����ݵ��ӵ�ʧ�غ��֪����ԭ����������ʵ���Ϊ
��x��0.15mol��y��0.075mol������Cu2O�����ʵ���Ϊ0.075mol����ɫ������뵽������ϡ�����У�ͭ����������+2��ͭ���ӣ�����ת�Ƶ����ʵ���Ϊ0.15mol��2+0.075mol��2��0.45mol��������еĵ���+5�۱���ԭΪ+2�۵�NO�����ݵ��ӵ�ʧ�غ��֪����ԭ����������ʵ���Ϊ![]() ��0.15mol��
��0.15mol��


 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��SO2����Ҫ�Ĵ�����Ⱦ���壬���û�ѧ��Ӧԭ����������Ⱦ����Ҫ������
I.�״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��![]() CH3OH��g�� ��H1��-116kJ��mol-1
CH3OH��g�� ��H1��-116kJ��mol-1
��1�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���___��
A����ʱ��CH3OH�뷴Ӧ�������� B�����ͷ�Ӧ�¶�
C��������ϵѹǿ D��ʹ�ø�Ч����
��2����֪��CO��g��+2H2��g��![]() CH3OH��g�� ��H1��-116kJ��mol-1
CH3OH��g�� ��H1��-116kJ��mol-1
CO��g��+![]() O2(g)=CO2��g�� ��H2��-283kJ��mol-1
O2(g)=CO2��g�� ��H2��-283kJ��mol-1
H2��g��+![]() O2(g)=H2O(g) ��H3
O2(g)=H2O(g) ��H3
��ѧ�� | H��H | O=O | O��H |
����/KJmol-1 | 436 | 498 | 463.5 |
���H3=___����ʾ1mol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ___��
��.���¶ȸ���500 Kʱ����ѧ�ҳɹ����ö�����̼�������ϳ����Ҵ���2CO2��g����6H2��g��![]() C2H5OH��g����3H2O��g�������ڽ��ܼ��š�����̼�ŷŷ�������ش����塣�ش��������⣺
C2H5OH��g����3H2O��g�������ڽ��ܼ��š�����̼�ŷŷ�������ش����塣�ش��������⣺
��1����ƽ�ⳣ������ʽΪK=____��
��2���ں����ܱ������У��ж�������Ӧ�ﵽƽ��״̬��������___��
a����ϵѹǿ���ٸı� b��H2��Ũ�Ȳ��ٸı�
c��������ܶȲ���ʱ��ı� d����λʱ��������H2��CO2�����ʵ���֮��Ϊ3��1
��3����һ��ѹǿ�£������CO2��ȡCH3CH2OH��ʵ�������У���ʼͶ�ϱȡ��¶���CO2��ת���ʵĹ�ϵ��ͼ������ͼ������
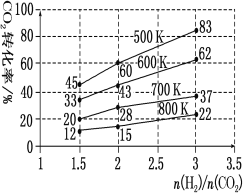
�ٽ����¶ȣ�ƽ����____�����ƶ���
����700K����ʼͶ�ϱ�![]() =1.5ʱ��H2��ת����Ϊ___��
=1.5ʱ��H2��ת����Ϊ___��
����500K����ʼͶ�ϱ�![]() ��2ʱ���ﵽƽ���H2��Ũ��Ϊamol��L��1����ﵽƽ��ʱCH
��2ʱ���ﵽƽ���H2��Ũ��Ϊamol��L��1����ﵽƽ��ʱCH
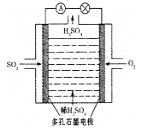
��.ijѧϰС����SO2Ϊԭ�ϣ�����ԭ��ط���ȡ���ᡣ��С����Ƶ�ԭ���ԭ����ͼ��ʾ���õ�����Ҳ�Ϊ___����д���õ�ظ����ĵ缫��Ӧʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������£��������ؾ����������ṹ�����������Ļ��ϼ۲���Ϊ0�ۣ�����Ϊ![]() �ۡ���ͼΪ�������ؾ����һ����������������С���ظ���Ԫ����������˵���д�����ǣ� ��
�ۡ���ͼΪ�������ؾ����һ����������������С���ظ���Ԫ����������˵���д�����ǣ� ��

A.�������صĻ�ѧʽΪKO2��ÿ����������4��K+��4��O2-
B.�����У�ÿ��O2-��Χ���������O2-��8��
C.��������ÿ��K+��Χ��8��O2-
D.�����У�0������-2��������Ŀ��Ϊ3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
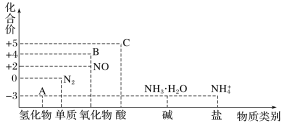
����Ŀ���о������仯��������ʣ�������Ч������������滷������Ԫ�ػ��ϼ�����������ϵͼ���¡�
�ش��������⣺
��1���ڴ����ͼ��ȵ������£�����A����NO�ǹ�ҵ���������Ҫ��Ӧ����ѧ����ʽ��_______��
��2���ڼ��������£�����C��Ũ��Һ��̼���ʷ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ��_______��
��3��ʵ�����У�������Һ�к���NH4+�IJ���������_________��
��4������BΪ����ɫ���壬д����������ˮ��Ӧ�����ӷ���ʽ��__________������Ӧ����3.36L����״��������Bʱ��ת�Ƶ��ӵ����ʵ���Ϊ________mol��
��5��д��һ���˹��̵��Ļ�ѧ��Ӧԭ��_______��
��6��Cu��һ��Ũ�ȵ�������Һ��Ӧ����NOʱ�����ӷ�Ӧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��п���仯������;�㷺���ش��������⣺
��1��Zn2+�ļ۲���ӹ������ʽΪ__��
��2��Ԫ�صڶ������ܣ�I2����Zn_Cu���������������������
��3��±��п���۵������ʾ��
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
�ܵ�/�� | 872 | 275 | 394 | 446 |
��ZnCl2��ZnBr2��ZnI2���۵�ʱ��б仯���ɵ�ԭ��___��
��ZnF2���۵�Զ������������±��п����ԭ��Ϊ___��
��4���ڰ�����ण�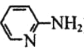 ����ͭ��������л����Գƺϳ�������յ�ЧӦ����ṹ��ʽ��ͼ��ʾ��
����ͭ��������л����Գƺϳ�������յ�ЧӦ����ṹ��ʽ��ͼ��ʾ��
���ڰ�����व�ͭ������У�Cԭ���ӻ�����Ϊ__��
��1mol![]() ����������������Ŀ֮��Ϊ__��
����������������Ŀ֮��Ϊ__��
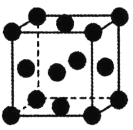
��5��ͭ�ľ���Ϊ������������ͼ��ʾ������֪��������Ϊa����þ����Ŀռ�������Ϊ__����Բ����Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.һ�о���ѧϰС���ij��ҵ���еĿ�����Ⱦ�����������о���
(1)С��һͬѧ���������������ձ���������ó����ۣ��ó��п�����Ⱦ����Ҫԭ���У�A.ʹ��ʯ��Һ���� B.ȼ�պ���ú C.�۳���Ⱦ��һͬѧ��Ϊ����һ�������ų���ԭ���ǣ�D______��Ŀǰ���п�����Ⱦ����Ҫ�к��ɷ���______ (�û�ѧʽ��ʾ)��
(2)������Ⱦ�γ����꣮�о���ѧϰС��Ը��е���ˮ�����˲�����������ղɼ�ʱ���pHΪ4.82�������ձ��о�2h���ٴβ��pHΪ4.68.�Դˣ���ĺ����Ľ�����______��
��.��һ�ܱ������з�����Ӧ 2NO2![]() 2NO+O2��H>0����Ӧ������NO2��Ũ����ʱ��仯�������ͼ��ʾ����ش�
2NO+O2��H>0����Ӧ������NO2��Ũ����ʱ��仯�������ͼ��ʾ����ش�
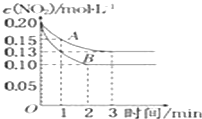
��������A����Ӧ��ǰ3min��������ƽ����Ӧ����Ϊ______��
��������A��B�ֱ��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ������������������______ (����Ũ��������ѹǿ�������¶�������������)��
(3)һ���¶��£����ܱ�������N2O5�ɷ������з�Ӧ��
��2N2O5 (g) ![]() 4NO2 (g)+O2 (g)
4NO2 (g)+O2 (g)
��2NO2(g) ![]() 2NO(g)+O2 (g)����ƽ��ʱ��c(NO2)=0.4mol/L��c(O2)=1.3mol/L��
2NO(g)+O2 (g)����ƽ��ʱ��c(NO2)=0.4mol/L��c(O2)=1.3mol/L��
��Ӧ����NO2��ת����Ϊ______��N2O5 (g)����ʼŨ��Ӧ������______ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����ұ�(GB2760-2011)�涨���Ѿ���SO2���ʹ����Ϊ0.25gL-1��ij��ȤС����ͼ1װ��(�г�װ����)�ռ�ij���Ѿ���SO2�������京�����вⶨ��
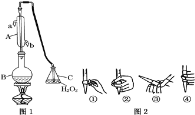
(1)����A�������� ______��ˮͨ��A�Ľ���Ϊ ______��
(2)B�м���300.00mL���Ѿƺ��������ᣬ����ʹSO2ȫ���ݳ�����C��H2O2��ȫ��Ӧ���仯ѧ����ʽΪ ______
(3)��ȥC�й�����H2O2��Ȼ����0.090 0molL-1NaOH����Һ���еζ����ζ�ǰ������ʱ��Ӧѡ��ͼ2�е� ______ �����ζ��յ�ʱ��Һ��pH=8.8����ѡ���ָʾ��Ϊ ______ ������50mL�ζ��ܽ���ʵ�飬���ζ����е�Һ���ڿ̶���10�����������Һ������(�����) ______ (��=10mL����=40mL����<10mL����>40mL)
(4)�ζ����յ�ʱ������NaOH��Һ25.00mL�������Ѿ���SO2����Ϊ��______ gL-1��
(5)�òⶨ�����ʵ��ֵƫ�ߣ�����ԭ����������װ������Ľ���ʩ��______��
(6)�����£���һ������NaOH��Һ�����ݳ���SO2���壬���պ������Һǡ�ó����ԣ����й�������Һ��˵����ȷ����______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ȷ���ǣ�������
A. ��ӦCaCO3(s)===CaO(s)��CO2(g)�ڳ����²����Է����У���÷�Ӧ����H<0
B. ��¯�г�����CaSO4���ñ���Na2CO3��Һ���ݣ��ٽ���������ϡ�����ܽ��ȥ
C. �����ò���ƿ��ʢװ������ˮ��Һ
D. ������Ksp[Mg(OH)2]=5.6��10-12��pH=10�ĺ�Mg2+��Һ����c(Mg2+)��5.6��10-4mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���
CO(g) +2H2(g) ![]() CH3OH(g) ��H<0
CH3OH(g) ��H<0
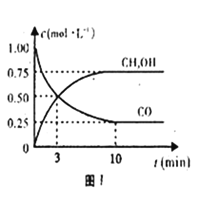
��1��ͼ1�DZ�ʾһ���¶��£������Ϊ2L���ܱ������м���5mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯�������Ӧ��10���Ӵﵽƽ�⣬�ӷ�Ӧ��ʼ��ƽ�⣬��H2��ʾƽ����Ӧ����v(H2)=______��
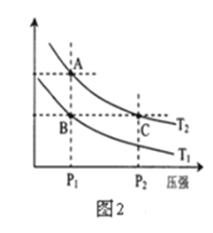
��2��ͼ2��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��H2�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����A______C������������������������������ͬ����A��C����Ļ�ѧƽ�ⳣ��A______C����״̬B��״̬A���ɲ���______�ķ�����������������������������
��3�����������£����д�ʩ����ʹ![]() ��С����______
������______
A�������¶� B������He�� C���ٳ���2molCO��5molH2 D��ʹ�ô���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com