
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
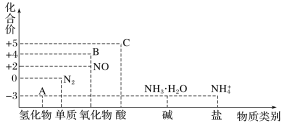
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
【答案】
![]() 取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有
取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有![]()
![]()
![]()
![]() 3Cu+8H++2NO3-=Cu2++4H20+2NO
3Cu+8H++2NO3-=Cu2++4H20+2NO![]()
【解析】
![]() 在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水;
在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水;![]() 在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水;
在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水;![]() 铵根离子结合氢氧根离子受热条件下反应生成氨气,遇到湿润的红色石蕊试纸变蓝;
铵根离子结合氢氧根离子受热条件下反应生成氨气,遇到湿润的红色石蕊试纸变蓝;![]() 物质B为红棕色气体为
物质B为红棕色气体为![]() ,二氧化氮和水反应生成硝酸和一氧化氮,结合元素化合价变化计算电子转移总数;
,二氧化氮和水反应生成硝酸和一氧化氮,结合元素化合价变化计算电子转移总数;
(5)合成氨是人工固氮最常用的方法;
(6)Cu与稀硝酸反应生成硝酸铜、水和一氧化氮。据此回答。
![]() 在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:
在催化剂和加热的条件下,物质A生成NO,是氨气的催化氧化生成一氧化氮和水,反应的化学方程式为: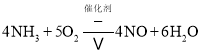 ;故答案为:
;故答案为: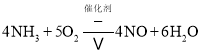 ;
;![]() 在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:
在加热条件下,物质C为硝酸,硝酸的浓溶液与碳单质反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:![]() ;故答案为:
;故答案为:![]() ;
;![]() 实验室中,检验溶液中含有
实验室中,检验溶液中含有![]() 的操作方法是:取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有
的操作方法是:取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有![]() ;
;
故答案为:取少量试液于试管中,加入氢氧化钠溶液,稍微加热,有湿润的红色石蕊试纸变蓝的气体产生,证明溶液中含有![]() ;
;![]() 物质B为红棕色气体为
物质B为红棕色气体为![]() ,二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:
,二氧化氮和水反应生成硝酸和一氧化氮,反应的离子方程式为:![]() ,反应中氮元素化合价
,反应中氮元素化合价![]() 价变化为
价变化为![]() 价和
价和![]() 价,3mol二氧化氮反应电子转移总数2mol,当反应消耗
价,3mol二氧化氮反应电子转移总数2mol,当反应消耗![]() 标准状况
标准状况![]() 物质B时,物质的量
物质B时,物质的量![]() ,转移电子的物质的量为
,转移电子的物质的量为![]() ;故答案为:
;故答案为:![]() ;
;![]() ;
;
![]() 人工固氮常用的是合成氨:
人工固氮常用的是合成氨:![]() ,故答案为:
,故答案为:![]() ;
;
(6)Cu与稀硝酸反应的离子方程式为:3Cu+8H++2NO3-=Cu2++4H20+2NO![]() ,故答案为:3Cu+8H++2NO3-=Cu2++4H20+2NO
,故答案为:3Cu+8H++2NO3-=Cu2++4H20+2NO![]() 。
。


科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是全球首次发现的新亚型流感病毒,达菲(Tamiflu)是治疗该病毒的最佳药物.以莽草酸为原料,经多步反应可制得达菲和对羟基苯甲酸.达菲、莽草酸、对羟基苯甲酸的结构简式如下:
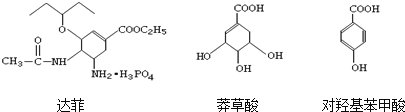
下列有关说法正确的是( )
A. 达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物
B. 1mol莽草酸与NaOH溶液反应,最多消耗4mol NaOH
C. 对羟基苯甲酸较稳定,在空气中不易被氧化
D. 利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

A.X、Y、Z分子中均含有2个手性碳原子
B.X、Y、Z均能与FeCl3溶液发生显色反应
C.1molY最多能消耗2molH2
D.1molZ与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中很多规律![]() 性质
性质![]() 都有其适用范围,下列根据其推出的结论正确的是( )
都有其适用范围,下列根据其推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 主族元素最高正化合价等于族序数 | 第ⅦA族元素最高正价都是+7 |
B | SO2和湿润的 | 二者混合后漂白性更强 |
C | 常温下铜与浓硝酸反应可以制取 | 常温下铁与浓硝酸反应也可以制取 |
D | 较强酸可以制取较弱酸 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
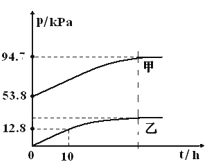
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高一某研究性学习小组在化学实验研修时探究氢气还原氧化铜实验.
(1)理论计算:称取24.0g CuO进行实验,若H2足量,应该可以得到Cu的质量为______ g
(2)实验:待24.0g CuO完全变成红色固体,冷却,称量,得固体20.4g.这个反常现象激发了学生的兴趣;
(3)一组学生查阅资料:
Ⅰ.H2还原CuO时还可能得到氧化亚铜(CuO),CuO为红色固体,不溶于水;
Ⅱ.Cu2O能与稀硫酸反应:CuO+HSO=CuSO+Cu+HO;
Ⅲ.Cu2O能与稀硝酸反应:3CuO+14HNO(稀)=6Cu(NO)+2NO↑+7HO;
Ⅳ.Cu能与稀硝酸反应:3Cu+8HNO(稀)=3Cu(NO)+2NO↑+4HO;
讨论:可以选择足量的______(填“稀硫酸”或“稀硝酸”)判断红色固体中混有Cu2O; 现象是______;
(4)另一组学生认为通过计算,即可确认固体成分是Cu与Cu2O的混合物.20.4g红色固体中Cu2O的物质的量为______mol;将20.4g红色固体加入到体积为200mL足量的稀硝酸中,被还原的硝酸的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H[3—亚甲基异苯并呋喃—1(3H)—酮]常被用来合成药物。它的一种合成路线如图:
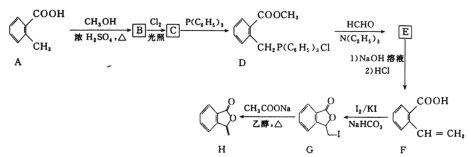
已知: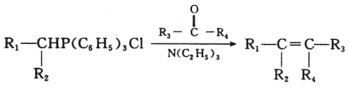 其中R1、R2、R3、R4为烃基或氢原子
其中R1、R2、R3、R4为烃基或氢原子
回答下列问题:
(1)C中所含官能团的名称是___。
(2)E的结构简式是___,G→H的反应类型是___。
(3)G与NaOH溶液反应的化学方程式是__。
(4)F的同分异构中符合下列条件的共有__种(不考虑立体异构)。
①能够与氯化铁溶液发生显色反应;
②能够与新制氢氧化铜浊液反应生成红色沉淀;
③分子中除苯环外无其他环状结构。
其中核磁共振氢谱共有六组峰,面积之比为2∶2∶1∶1∶1∶1的结构简式是__。
(5)写出以![]() 、P(C6H5)3、N(C2H5)3和丙酮(
、P(C6H5)3、N(C2H5)3和丙酮(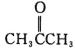 )为原料制备
)为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1) 写出As的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3) Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
(4) 砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com