
【题目】鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )

A.X、Y、Z分子中均含有2个手性碳原子
B.X、Y、Z均能与FeCl3溶液发生显色反应
C.1molY最多能消耗2molH2
D.1molZ与NaOH溶液反应最多消耗3molNaOH
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
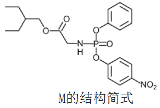
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
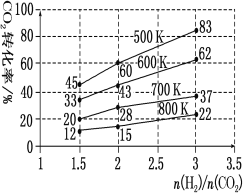
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
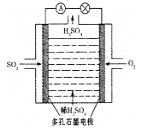
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
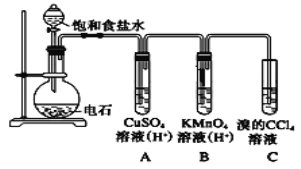
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白皮杉醇具有抗炎、抗菌、抗氧化、抗白血病、提高免疫调节功能等功效,其人工合成过程涉及了如下转化:
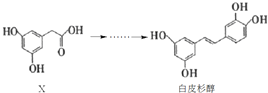
下列说法正确的是
A.X的分子式为C8H10O4
B.化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体
C.白皮杉醇与浓溴水反应时,最多可消耗6molBr2
D.在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S![]() 6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____;该晶体中原子之间的作用力是____。
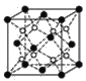
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____。
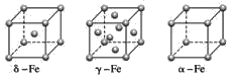
(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____,δ、α两种晶胞中铁原子的配位数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为![]() 价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )
价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中,每个O2-周围距离最近的O2-有8个
C.晶体中与每个K+周围有8个O2-
D.晶体中,0价氧与-2价氧的数目比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
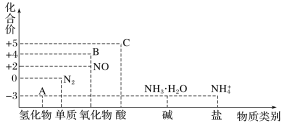
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com