
【题目】化学中很多规律![]() 性质
性质![]() 都有其适用范围,下列根据其推出的结论正确的是( )
都有其适用范围,下列根据其推出的结论正确的是( )
选项 | 规律 | 结论 |
A | 主族元素最高正化合价等于族序数 | 第ⅦA族元素最高正价都是+7 |
B | SO2和湿润的 | 二者混合后漂白性更强 |
C | 常温下铜与浓硝酸反应可以制取 | 常温下铁与浓硝酸反应也可以制取 |
D | 较强酸可以制取较弱酸 |
|
A.AB.BC.CD.D
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】某实验小组学生利用装置用![]() 盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
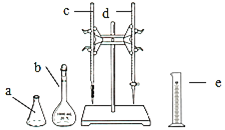
(1)量取![]() 待测NaOH溶液时,用到的测量仪器是 ______
待测NaOH溶液时,用到的测量仪器是 ______ ![]() 填仪器标号
填仪器标号![]() .
.
(2)仪器![]() 中,需要用待装液润洗的有 ______
中,需要用待装液润洗的有 ______ ![]() 填字母
填字母![]()
(3)该滴定实验过程中,判定滴定终点的依据是 ______
(4)该实验小组重复三次的实验数据如下表所示,计算NaOH溶液的浓度为 ______
实验序号 | 盐酸体积 | NaOH溶液体积 |
1 |
|
|
2 |
|
|
3 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
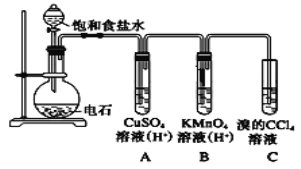
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S![]() 6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
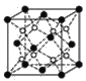
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____;该晶体中原子之间的作用力是____。
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____。
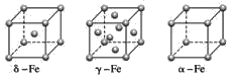
(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____,δ、α两种晶胞中铁原子的配位数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为![]() 价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )
价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中,每个O2-周围距离最近的O2-有8个
C.晶体中与每个K+周围有8个O2-
D.晶体中,0价氧与-2价氧的数目比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
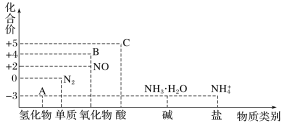
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一研究性学习小组对某工业城市的空气污染进行了下列研究。
(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有:A.使用石油液化气 B.燃烧含硫煤 C.粉尘污染另一同学认为还有一个不可排除的原因是:D______。目前城市空气污染的主要有害成分是______ (用化学式表示)。
(2)空气污染形成酸雨.研究性学习小组对该市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68.对此,你的合理的解释是______。
Ⅱ.在一密闭容器中发生反应 2NO2![]() 2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
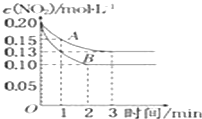
①依曲线A,反应在前3min内氧气的平均反应速率为______。
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是______ (填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5 (g) ![]() 4NO2 (g)+O2 (g)
4NO2 (g)+O2 (g)
②2NO2(g) ![]() 2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
则反应②中NO2的转化率为______,N2O5 (g)的起始浓度应不低于______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]() ,
,![]() 为正四面体结构,其中P-P键的键能为
为正四面体结构,其中P-P键的键能为![]() ,
,![]() 的键能为
的键能为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.该反应在任何温度下都能自发
B.![]() 和
和![]() 具有的总能量比
具有的总能量比![]() 具有的能量低
具有的能量低
C.![]() 的电子式为:
的电子式为:![]()
D.![]() 键的键能为
键的键能为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com