
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
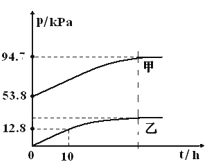
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
【答案】乙 28.2 3.38 0.05
【解析】
①根据最开始氧气的压强得出。
②根据氧气压强求算改变的压强,再根据起始压强求分解到10h时的压强,再根据速率公式计算。
③根据三段式计算,再求平衡时压强平衡常数。
①根据反应分析,随着反应的进行氧气的压强从0开始逐渐增大,所以乙为氧气的压强曲线,故答案为:乙。
②t=10h时,pO2=12.8 kPa ,2N2O5(g) = 4NO2(g)+O2(g)分析,反应的五氧化二氮的分压为25.6 kPa ,起始压强为53.8 kPa,所以10h时pN2O5=53.8kPa-25.6 kPa=28.2 kPa ,N2O5 分解的反应速率υ=0.12pN2O5(kPah-1)= 0.12×28.2= 3.38 kPah-1,故答案为:28.2;3.38。
③2N2O5(g) = 4NO2(g)+O2(g),
53.8kPa 0 0
53.8kPa 107.6kPa 26.9kPa
0 107.6kPa 26.9kPa
2NO2![]() N2O4
N2O4
起始分压107.6kPa 0
改变分压2x x
平衡分压107.6kPa-2x x
有107.6kPa-2x+x+26.9kPa=94.7 ,解x=39.8 kPa,平衡常数Kp=![]() =0.05kPa-1,故答案为:0.05。
=0.05kPa-1,故答案为:0.05。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物 G 是一种药物合成中间体,其合成如下:
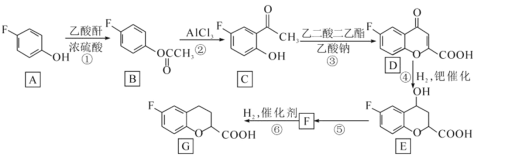
已知乙酸酐的结构简式为 CH3COOCOCH3。请回答下列问题:
(1)G 中含氧官能团的名称是_____。
(2)反应①的化学方程式为_____。
(3)写出反应⑤所需的试剂和条件是_____,该反应类型是_____。
(4)写出满足下列条件的 C 的同分异构体的结构简式_____、_____。
Ⅰ.苯环上只有两种取代基;
Ⅱ.核磁共振氢谱图中只有 4 组吸收峰;
Ⅲ.能与 NaHCO3 溶液反应生成二氧化碳。
(5)碳原子上连有 4 个不同的原子或基团时,该碳称为手性碳。则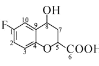 中的手性碳原子是_____(填碳原子的数字标号)。
中的手性碳原子是_____(填碳原子的数字标号)。
(6)设计以![]() (丙酸苯酚酯)为原料制备
(丙酸苯酚酯)为原料制备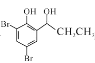 的合成路线(无机试剂任选)_____。
的合成路线(无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是2Cu2O+Cu2S![]() 6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
6Cu+SO2↑。则29Cu的外围电子轨道表示式为____;比较Cu2O与Cu2S,熔点较高的是____,原因为____。
(2)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为____;该晶体中原子之间的作用力是____。
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似(如图),该晶体储氢后的化学式应为____。
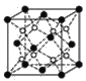
(4)铁有δ、γ、α三种同素异形体(如图),γ晶体晶胞中所含有的铁原子数为____,δ、α两种晶胞中铁原子的配位数之比为____。
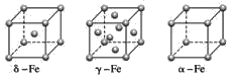
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
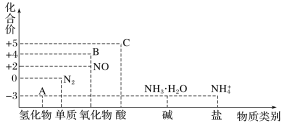
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行实验研究时,需要配制500mL 0.1molL﹣1 Na2CO3溶液.
(1)经过计算,使用托盘天平应该称量______g Na2CO3固体;
(2)配制溶液时,除了托盘天平、药匙、量筒、烧杯、玻璃棒外,还需要的仪器有______;
(3)配制溶液时,需经过称量、溶解、转移溶液、______、定容、摇匀等操作.下列图示对应的操作规范的一个是______;
A 称量
B 溶解
C 转移
D 转移![]()
(4)误差(填偏高、偏低、无影响)
若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度______;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,则所配溶液的浓度______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一研究性学习小组对某工业城市的空气污染进行了下列研究。
(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有:A.使用石油液化气 B.燃烧含硫煤 C.粉尘污染另一同学认为还有一个不可排除的原因是:D______。目前城市空气污染的主要有害成分是______ (用化学式表示)。
(2)空气污染形成酸雨.研究性学习小组对该市的雨水进行了采样与分析,刚采集时测得pH为4.82,放在烧杯中经2h后,再次测得pH为4.68.对此,你的合理的解释是______。
Ⅱ.在一密闭容器中发生反应 2NO2![]() 2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示,请回答:
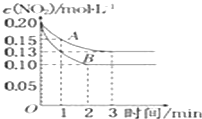
①依曲线A,反应在前3min内氧气的平均反应速率为______。
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是______ (填“浓度”、“压强”、“温度”或“催化剂”).
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5 (g) ![]() 4NO2 (g)+O2 (g)
4NO2 (g)+O2 (g)
②2NO2(g) ![]() 2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
2NO(g)+O2 (g)若达平衡时,c(NO2)=0.4mol/L,c(O2)=1.3mol/L,
则反应②中NO2的转化率为______,N2O5 (g)的起始浓度应不低于______ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的有几个()
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现![]() 与
与![]() 之间的相互转化
之间的相互转化
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
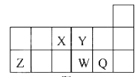
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C.元素W的最高价氧化物对应的水化物的酸性比Q的强
D.离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com