
【题目】为测定某有机化合物A的结构,进行如下实验。
I.分子式的确定
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质的实验式是; ;
(2)质谱仪测定有机物A的相对分子质量为46,则该物质的分子式是 ;
(3)预测A的可能结构并写出结构简式 。
II.结构式的确定
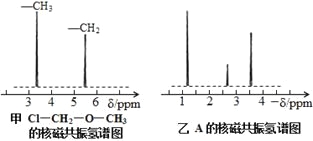
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl―CH2―O―CH3)有两种氢原子(见图甲)。经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为 。
III.性质实验
(5)A在一定条件下脱水可生成B,B可合成用于食品包装的塑料C,请分别写出转化反应化学方程式:
A→B: ;
B→C: 。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】将2.32 g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中缓慢逐滴加入浓度为 0.1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )
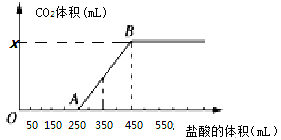
A.OA段发生反应的离子方程式为:H++OH-===H2O CO+H+===HCO
B.当加入350 mL盐酸时,产生CO2的体积为224 mL(标准状况)
C.x点对应的数值是448
D.混合物中NaOH的质量为1克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水中存在着如下沉淀溶解平衡:Cu(OH)2(s) ![]() Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH标准液滴定未知浓度的醋酸溶液,下列操作会导致测定结果偏高的是
A. 以甲基橙为指示剂滴至溶液由红色变橙色
B. 滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失
C. 读滴定管读数时,滴定前仰视,终点时俯视
D. 振荡时锥形瓶中的液滴溅出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体,此液体不具有的性质是( )
A.光束通过该液体时形成光亮的“通路”
B.插入石墨电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热、蒸干、灼烧后,有氧化物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是
A. H+、Ba2+、Fe3+、NO3-,通入SO2气体
B. AlO2-、Na+、Br-、SO42-,通入CO2气体
C. Ca2+、Cl-、K+、H+,通入CO2气体
D. HCO3-、Na+、I-、HS-,加入AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | ||||
3 | Na | Mg | Al | S | Cl | Ar |
(1)非金属性最强的元素是 ;
(2)化学性质最不活泼的单质是 ;
(3)C和O中,原子半径较大的是 ;
(4)某离子的结构示意图为![]() ,该离子的符号为__________;
,该离子的符号为__________;
(5)硫有两种重要氧化物,分别为SO2和 (填化学式);
(6)H2S和HCl中,热稳定性较强的是 ;
(7)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是 ;属于两性氢氧化物的是 ;
(8)氮的一种气态氢化物的分子球棍模型如图所示,写出它的化学式 ,其水溶液显 (填“酸性”或“碱性”),此氢化物中N元素和H元素的质量比m(N)∶m(H)= ;
(相对原子质量:N一14 H—1)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与胶体无关的是
A. 胶体分散质粒子直径大小在1100 nm之间
B. 当日光从窗隙射入暗室时,可观察到一束光线
C. 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
D. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com