
 N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。 | 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
| 实验步骤 | 实验现象 | 实验结论 |
| ②将二支注射器分别插入装有热水、冰水的烧杯中(1分);几分钟后拿出作对比。(1分) | 浸入热水的注射器中的气体颜色变深;(1分) 浸入冰水的注射器中的气体颜色变浅。(1分) | 在其他条件不变的情况下(1分),温度升高,会使化学平衡向着吸热反应的方向移动;温度降低会使化学平衡向放热反应的方向移动(1分)(只答一方面也给1分) |
| 实验步骤 | 实验现象 | 实验结论 |
| ②将一支注射器的活塞迅速往里推到一定位置,然后与另一支注射器的气体作对比(1分);回复原状后再将注射器的活塞迅速往外拉到一定位置,然后与另一支注射器的气体作对比(1分) | 迅速推动注射器,针管内气体颜色先变深后慢慢变浅(1分);迅速拉伸注射器时,针管内气体颜色先变浅后深慢慢变深。(1分) | 在其他条件不变的情况下(1分),增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。(1分)(只答一方面也给1分) |
| 实验步骤 | 实验现象 | 实验结论 |
| ②将二支注射器分别插入装有热水、冰水的烧杯中(1分);几分钟后拿出作对比。(1分) | 浸入热水的注射器中的气体颜色变深;(1分) 浸入冰水的注射器中的气体颜色变浅。(1分) | 在其他条件不变的情况下(1分),温度升高,会使化学平衡向着吸热反应的方向移动;温度降低会使化学平衡向放热反应的方向移动(1分)(只答一方面也给1分) |
| 实验步骤 | 实验现象 | 实验结论 |
| ②将一支注射器的活塞迅速往里推到一定位置,然后与另一支注射器的气体作对比(1分);回复原状后再将注射器的活塞迅速往外拉到一定位置,然后与另一支注射器的气体作对比(1分) | 迅速推动注射器,针管内气体颜色先变深后慢慢变浅(1分);迅速拉伸注射器时,针管内气体颜色先变浅后深慢慢变深。(1分) | 在其他条件不变的情况下(1分),增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。(1分)(只答一方面也给1分) |


科目:高中化学 来源:不详 题型:填空题

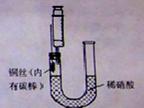
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
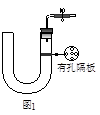

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液。 | |
| 第二步 | | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(NH4)2SO4 | B.NH4NO3 | C.NH4Cl | D.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中一定无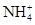 |
| B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体 |
| C.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色 |
| D.46 g NO2和N2O4混合气体中含有原子总数为3NA,含有的分子总数为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
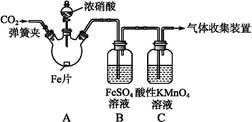
 Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| B.在KI-淀粉溶液中通入氯气,溶液变蓝,是因为生成的单质碘与淀粉发生显色反应 |
| C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO42- |
| D.实验室可用氯化铵与氢氧化钙加热制取氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
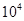 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。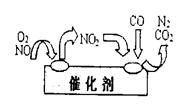
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
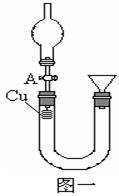
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com