
����Ŀ��PbI2������ɫ��ĩ����������������̫���ܵ�ص������������װ�Ǧ���ԭ�ϡ��ϳ�PbI2��ʵ��������ͼ1��
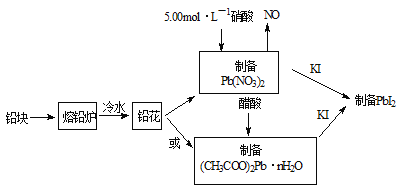

��1����Ǧ���Ƴ�Ǧ����Ŀ����_____________��
��2��31.05gǦ����5.00mol��L��1�������ܽ⣬����������5.00 mol��L��1����_______mL��
��3��ȡһ������(CH3COO)2Pb��nH2O��Ʒ��N2�����м��ȣ������Ʒ��������ʣ���![]() �����¶ȵı仯��ͼ2��ʾ����֪����Ʒ��75��ʱ����ȫʧȥ�ᾧˮ����
�����¶ȵı仯��ͼ2��ʾ����֪����Ʒ��75��ʱ����ȫʧȥ�ᾧˮ����
��(CH3COO)2Pb��nH2O�нᾧˮ��Ŀn=__________������������
��100��200���ֽ����ΪǦ���������һ���л������л���Ϊ___________��д����ʽ����
��4����ȡһ��������PbI2���壬������ˮ���Ƴ�����ʱ�ı�����Һ��ȷ��ȡ25.00mL PbI2������Һ�ִμ��������ӽ�����֬RH�У�������2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq)������ƿ��������Һ�����������ˮ��ϴ��֬������Һ�����ԣ���ϴ��Һ�ϲ�����ƿ�С�����2��3�η�̪��Һ����0.002500mol��L��1NaOH��Һ�ζ������ζ��յ�ʱ��ȥ�������Ʊ���Һ20.00mL��������ʱPbI2��KspΪ___________��
��5��̽��Ũ�ȶԻǻ�Ǧ�����ܽ�ƽ���Ӱ�졣
�û�ѧС��������ṩ�Լ��������ʵ�飬��˵��Ũ�ȶԳ����ܽ�ƽ���Ӱ�졣
�ṩ�Լ���NaI������Һ��NaCl������Һ��FeCl3������Һ��PbI2������Һ��PbI2����Һ��
��Ϣ��ʾ��Pb2+��Cl�����γɽ��ȶ���PbCl42�������ӡ�
����д�±��Ŀհ״���
ʵ������ | ʵ�鷽�� | ʵ������ԭ����� |
�ٻ�����Ũ�������ƽ���Ӱ�� | ȡPbI2������Һ������һ֧�Թ��У��ٵ��뼸��NaI������Һ | ������Һ��c(I��)����ʹQ������PbI2��Ksp |
��Ǧ����Ũ�ȼ�С��ƽ���Ӱ�� | ________ | ����________ ԭ��________ |
��________ | ��PbI2����Һ�е��뼸��FeCl3������Һ | ����ɫ������ʧ ________ |
���𰸡���������ĽӴ�������ӿ��ܽⷴӦ���� 80 3 C4H6O3 4��10��9 ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ ��ɫ������ʧ ԭ�����γ�PbCl42-��������Һ��c��Pb2+����С��ʹQcС����pbI2��Ksp Ǧ���Ӻ͵�����Ũ�ȶ���С��ƽ���Ӱ�� PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2
��������
��1����Ǧ���Ƴ�Ǧ������Ϊ���������ᷴӦ�ĽӴ�������ӿ��ܽⷴӦ���ʣ�
��2��31.05gǦ�����ʵ���Ϊ31.05g��207g/mol��0.15mol�����ݷ�Ӧ����ʽ��֪���ĵ�HNO3�����ʵ���Ϊ0.15mol��8/3=0.4mol�����ɵ�NO�����ʵ���Ϊ0.15mol��2/3=0.1mol����������Һ�����Ϊ0.4mol��5.00molL��1=0.08L=80.0mL��
��3���ټ�����Ʒ����ʼ����Ϊ100�ˣ����ݹ�������ʵĹ�ʽ��֪��75��ʱʣ�����Ϊ87.75�ˣ����ɵ�ˮ����Ϊ100g��87.75g=12.25g�������Ǧ��ˮ�����ʵ���֮��Ϊ![]() =1��3����n=3��
=1��3����n=3��
��Ǧ������������Ϊ58.84�ˣ�����Ǧ�����ʵ���Ϊ=![]() ������Ǧԭ���غ㣬Ǧ�������PbOx�������ʵ���Ϊ
������Ǧԭ���غ㣬Ǧ�������PbOx�������ʵ���Ϊ![]() �����������Ħ������Ϊ58.84g��
�����������Ħ������Ϊ58.84g��![]() =223g/mol��ΪPbO���л��������Ϊ85.75g��58.84g=26.91g�����л��������Ӧ�����ĸ�̼ԭ�ӣ����ʵ���Ϊ
=223g/mol��ΪPbO���л��������Ϊ85.75g��58.84g=26.91g�����л��������Ӧ�����ĸ�̼ԭ�ӣ����ʵ���Ϊ![]() mol��Ħ������Ϊ26.91g��
mol��Ħ������Ϊ26.91g��![]() =102������ԭ���غ��֪�л���ķ���ʽΪC4H6O3��
=102������ԭ���غ��֪�л���ķ���ʽΪC4H6O3��
��4��n��H+�� = n��NaOH�� =" 0.002500" molL��1 �� 20.00mL �� 10��3LmL��1 =" 5.000" �� 10��5mol �� n[Pb2+��aq��] =" 1/2" n��H+�� =" 2.500" �� 10��5 mol �� c��Pb2+�� =![]() =" 1.000" �� 10��3 molL��1 ��Ksp��PbI2�� = c��Pb2+��c2��I���� = 4c3��Pb2+�� =" 4" �� ��1.000��10��3��3=4.000��10��9��
=" 1.000" �� 10��3 molL��1 ��Ksp��PbI2�� = c��Pb2+��c2��I���� = 4c3��Pb2+�� =" 4" �� ��1.000��10��3��3=4.000��10��9��
��5��Ӱ�컯ѧƽ���ƶ���������Ũ�ȣ�����Ӧ���С�����Ũ�ȣ�����������У������������С��Ӧ�Ũ��ƽ��������У����ݵ⻯Ǧ���ܽ�ƽ�⣺PbI2��S��![]() Pb2+��aq��+2I-��aq������Һ��c��I-������ƽ��������У�Pb2+��Cl-���γɽ��ȶ���PbCl42-�����ӣ���������NaCl������Һ���ᵼ����Һ��c��Pb2+����С��ƽ�����ҽ��У�����Ǧ���Ӻ����������ӿ��Է���������ԭ��Ӧ����������FeCl3������Һ�������ĵ⻯Ǧ�������ƶ���
Pb2+��aq��+2I-��aq������Һ��c��I-������ƽ��������У�Pb2+��Cl-���γɽ��ȶ���PbCl42-�����ӣ���������NaCl������Һ���ᵼ����Һ��c��Pb2+����С��ƽ�����ҽ��У�����Ǧ���Ӻ����������ӿ��Է���������ԭ��Ӧ����������FeCl3������Һ�������ĵ⻯Ǧ�������ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��Һ����ѧ��ѧ����ũҵ�����г�����һ���Լ���
(1)ijͬѧ����CuSO4��Һʱ����ʢ��һ��������ͭ������ձ��м�������������ˮ�������Ͻ��裬����õ�����Һ������Ϊ�ǹ���û����ȫ�ܽ⣬���Ƕ�����Һ���ȣ�������ֻ��Ǹ������ˡ�ԭ���ǣ������ӷ���ʽ�ͼ�Ҫ����˵����ʾ��___________________________����������ձ��м�����һ������_________________��Һ���õ��˳����CuSO4��Һ��
(2)��ͬѧ�����Ƶõ�CuSO4��Һ������������ʵ��̽����
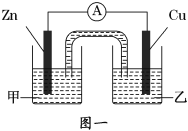
��ͼһ�Ǹ��ݷ�ӦZn+CuSO4�TCu+ZnSO4��Ƴɵ�пͭԭ��ء��������Һ����______��Һ��Cu���ĵ缫��Ӧʽ��____________________��
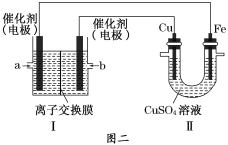
��ͼ���У����Ǽ���ȼ�ϵ��(�������ҺΪNaOH��Һ)�Ľṹʾ��ͼ����ͬѧ���ڢ���ʵ�����϶�ͭ����Fe�缫Ϊ__________(��������������������)����ͭ�缫����������3.2 g�������ĵ�CH4�ڱ�״���µ����Ϊ___________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ����
A.��CaCl2 ��Һ��ͨ������CO2���壺Ca2+ + CO2 + H2O=CaCO3�� + 2H+
B.����ʯ����ᷴӦ��CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO��+ H2O + CO2��
C.�Ʊ�Fe(OH)3���壺Fe3+ + 3H2O![]() Fe(OH)3�����壩+ 3H+
Fe(OH)3�����壩+ 3H+
D.����̼��������Һ������ʯ��ˮ��Ӧ��Ca2+ + OH��+ HCO3��=CaCO3�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������У���SO2 ��Һ̬�Ȼ��� ��CH4 ������NaOH ��NH4Cl���� �ް�ˮ���ܵ������__________������ţ���ͬ�������ڵ���ʵ���__________�����ڷǵ���ʵ���__________��
��2��1.204��1024��H2SO4���ӵ����ʵ���Ϊ__________mol������__________����ԭ�ӡ�������H2SO4����ˮ���600 mL��Һ���ټ�ˮϡ�͵�1000 mL��ϡ�ͺ���Һ�����ʵ���Ũ��Ϊ__________mol/L��
��3��K2SO4��Fe2��SO4��3�Ļ����Һ����֪����Fe3����Ũ��Ϊ0.5mol/L��SO42��Ũ��Ϊ0.9mol/L����K�������ʵ���Ũ��Ϊ__________mol/L��
��4���������������ʣ��� ��״����11.2 L CO2 �� 5 g H2 �� 1.204��1024��N2���� �� 18 g H2O����������������____������ţ����ڳ��³�ѹ�����������___������ţ���
��5����״����11.2 L��CH4��N2��ɵĻ�����������Ϊ10 g���û��������CH4��N2�ķ�����֮��Ϊ_________��
��6������״����336 L HCl������ȫ����1 Lˮ�У�������Һ���ܶ�Ϊ �� g/cm3�������Һ�����ʵ���Ũ��Ϊ_____ mol/L���������е����ֱ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʽṹ�����ʵ�˵������ȷ���� ( )
�������ܶȱ�ˮ���ܶ�С
��C2H6��C4H10��C6H14�ڳ����¾�Ϊ����
��1 mol�������3 mol H2�����ӳɷ�Ӧ������Ϊ�����Ӻ���3��̼̼˫��
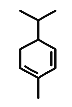
��ˮ��ϩ(��Ƥ�е�һ�ֳɷ�)����ʽ��ͼ�������ʽΪC10H16
��CH2=CH2��CH2=CH-CH=CH2��Ϊͬϵ��
�����������ڹ��յ������¿�����ȡ������һ�ȼ���
��C5H12������ͬ���칹��
A. �٢ڢ�B. �ۢܢ�C. �ۢݢ�D. �٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Ч���ÿ��Ի�������ЧӦ����Դ��ȱ���⡣
��1��CO2�ķ��ӽṹ�����������ʺ���;��
��CO2�ĵ���ʽ��_____________��
�����¶ȸ���31.26 ����ѹǿ����7.29��106Paʱ��CO2���ڳ��ٽ�״̬����Ϊ���ٽ�CO2���壬����������ȡ����ȡ��ҩ�е���Ч�ɷ֡������л��ܼ���ȡ��ȣ��ó��ٽ�CO2��ȡ���ŵ��У�___________(���һ�㼴��)��
��2���п�Ժ������ѧ�����о����Ŀ�����Ա���������״���Na-Fe3O4��HMCM-22 �ı��潫CO2ת��Ϊ���������������ͼ��

��ͼ��CO2ת��ΪCO�ķ�ӦΪ��CO2(g)+H2(g) = CO(g)+H2O(g) ��H= +41kJ/mol
��֪��2CO2(g)+6H2(g) = C2H4(g)+4H2O(g) ��H= -128kJ/mol
����ͼ��COת��ΪC2H4���Ȼ�ѧ����ʽ��____________________��
�ڹ���X��Y��˵����ȷ����________(����š���
a.ʵ��ʽ��ͬ b.����4��һ�ȴ���
c.����ʹ����KMnO4��Һ��ɫ d.��Ϊͬϵ��
�۴�����Fe3O4���Ʊ��������£���һ��������FeCl2��FeCl3�������ᣬȻ���� 60 ������μ���NaOH��Һ��pH��10���������裬��Fe3O4���÷�Ӧ�����ӷ���ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ʳƷ�����Ȱ��ϱ�ע�ijɷ������ۡ���ʯ�ҡ�С�մ����Ȱ����ˮ���ɴ������ȡ���ˮ�����з�������Ҫ��Ӧ��������
A. 2Al+Ca(OH)2+2H2O=Ca(AlO2)2+3H2��
B. Ca(OH)2+NaHCO3=CaCO3��+NaOH+H2O
C. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
D. CaO+H2O=Ca(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ(�ṹ��ͼ1��ʾ)��ʳƷ��ҵ�г��õ�һ���㾫������ϩ�۵�Ϊ-74��3�棬�е�Ϊ177�棬������ˮ���ڽӽ�100��ʱ��һ���Ļӷ��ԡ����ʡ����Ӻ����ӵ�ˮ����Ƥ�д��ڽ϶������ϩ��ʵ����ͨ����ˮ��������(װ����ͼ2��ʾ)�ķ���������ϩ�ӹ�Ƥ����ȡ���������к����ķ����ᴿ��
ˮ��������60g����Ƥ������ƬͶ������B�У�����30mL����ˮ����T�ιܻ�������ȼ�ƾ��Ƽ���ˮ��������װ�ã���T�ι�֧�ܿ��д���ˮ����ð��ʱ�رջ�������ʼͨ������ˮ����D���ռ���Լ60��70mL���Һʱֹͣ����
�����ᴿ�������Һ�����Һ©����ÿ����10mL���ȼ���(�е�39��95��)��ȡ���Σ���ȡҺ�ϲ���������ƿ�У�����������ˮ����þ����Сʱ����ˣ�����Һ���������ȥ���ȼ��飬������ƿ�еõ���Ҫ�ɷ�������ϩ�ij��͡�
��ش�������⡣

��1������A��������____����ȫ���¶˲��ܵ�ס����A�ĵײ���ԭ����__������B��ˮ��������ܹܿڽӽ�ƿ�ף�Ŀ����___��
��2��ֱ�����������ܷ����Ϊ����������___(���ܡ���)��ԭ����___��
��3�������ᴿ�����м�����ˮ����þ��������____������Һ��������ʱ���ʵļ��ȷ�����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ΪW1g���ơ��������Ͷ��һ������ˮ�г�ַ�Ӧ������û��ʣ�࣬��Һ���壬���ռ�����״���µ�����V1L������Һ����μ���Ũ��Ϊamol/L�����ᣬ�������а�ɫ�������ɺ������ܽ⣬������ǡ����ʧʱ�����������ΪV2L������Һ��HCl������С�����ɵù���W2g���������й�ϵʽ����ȷ����
A. 35.5a����W2��W1��V2B. n(Al)>![]() mol
mol
C. n(Na)��3n(Al)��![]() molD. aV2��
molD. aV2��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com