
【题目】下列有关钠和镁的说法中,不正确的是( )
A. 电解熔融NaCl可以得到金属钠
B. 金属钠在高温下能将TiCl4中的钛置换出来
C. 金属镁着火,可用氮气灭火
D. 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应 B. 通入CO后,正反应速率逐渐增大
C. CO的平衡转化率为80% D. 反应前H2S物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
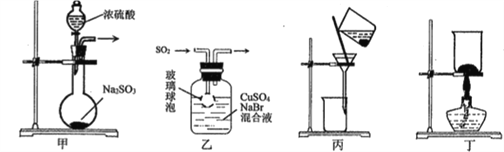
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是
CH3OH(g)达到平衡,下列说法正确的是
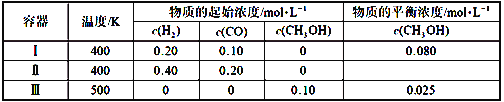
A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
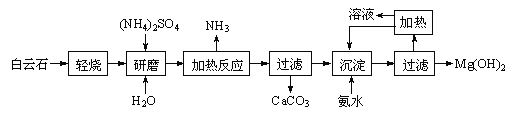
【题目】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
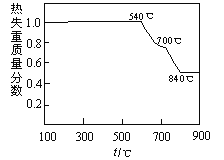
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____(填化学式)。结合上图判断“轻烧”温度应不超过 _____。
(2)“加热反应”的化学方程式为_________________________。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______(已知)。
(4)该工艺中可以循环使用的物质是________(填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石的方法,其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S ![]() Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
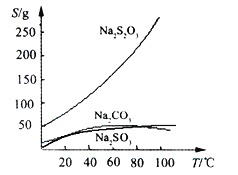

Ⅰ.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为_________________,装置6中可放入_____________________(填字母)。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是____________________________________(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并标定溶液的浓度:

(3)为减少产品的损失,操作①为__________,操作②是抽滤洗涤干燥,其中洗涤操作是用_______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高______________________________。
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-, 三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代酸钠溶液的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C,则有机物A的可能结构有( )
A. 1种B. 2种C. 3种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是___________________________;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
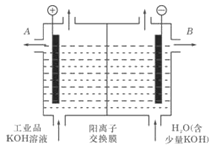
①该电解槽的阳极反应式是________________________;
②除去杂质后的氢氧化钾溶液从液体出口__________(填写“A”或“B”)导出。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
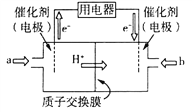
①通入气体a的电极是电池的________(填“正”或“负”)极,其电极反应式为___________________________________;
②当电池中有2 mol e-发生转移时,左右两侧溶液的质量差值为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com