
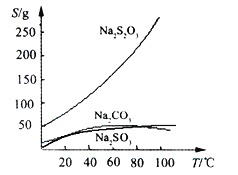
����Ŀ����������ƣ�Na2S2O3)�����������ƺ����ͨ�����Ϸ�Ӧ�Ƶã�Na2SO3 + S ![]() Na2S2O3����������Һ����������ΪNa2S2O35H2O��Na2S2O3��5H2O��40��45���ۻ���48��ֽ⣻Na2S2O3������ˮ���������Ҵ�����ˮ���й����ʵ��ܽ����������ͼ��ʾ��
Na2S2O3����������Һ����������ΪNa2S2O35H2O��Na2S2O3��5H2O��40��45���ۻ���48��ֽ⣻Na2S2O3������ˮ���������Ҵ�����ˮ���й����ʵ��ܽ����������ͼ��ʾ��

���ְ����·����Ʊ�Na2S2O35H2O��
�����ƺ�̼���ư���ӦҪ�����һ������������ƿ�У�ע��150mL����ˮʹ���ܽ⣬�ڷ�Һ©���У�ע��Ũ���ᣬ��װ��2�м����������ƹ��壬������ͼ��װ��װ�á�
��1������2������Ϊ_________________��װ��6�пɷ���_____________________(����ĸ)��
A.BaCl2��Һ B.ŨH2SO4 C.����KMnO4��Һ D.NaOH��Һ
��2����Һ©��������ע��Ũ����ʹ��Ӧ�����Ķ�����������Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У����ô������������������ȣ���Ӧԭ��Ϊ��
��Na2CO3+SO2 =Na2SO3+CO2 ��Na2S+SO2+H2O=Na2SO3+H2S
��2H2S+SO2=3S��+2H2O ��Na2SO3+S![]() Na2S2O3
Na2S2O3
�ܷ�ӦΪ��2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
���Ŷ������������ͨ�룬������Һ���д���dz��ɫ��������������ͨ�����������壬��ӦԼ��Сʱ������Һ��pH�ӽ���С��7ʱ������ֹͣͨ���ͼ��ȡ���ҺpHҪ���Ʋ�С��7������____________________________________�������ӷ���ʽ��ʾ����
����Na2S2O35H2O���궨��Һ��Ũ�ȣ�

��3��Ϊ���ٲ�Ʒ����ʧ��������Ϊ__________���������dz���ϴ�Ӹ������ϴ�Ӳ�������_______�����Լ�����ϴ�Ӽ���
��4������Ũ����Һֱ����Һ����ɫ����Ϊֹ������ʱΪʲôҪ�����¶Ȳ��˹���______________________________��
��5����ȡһ�������IJ�Ʒ���Ƴ������������Һ�����ü�ӵ������궨����Һ��Ũ�ȣ��÷�����ƽȷ��ȡ������K2Cr2O7��Ħ������294g/mol��0.5880�ˡ�ƽ���ֳ�3�ݷֱ����3����ƿ�У���ˮ�����Һ�������������KI���ữ���������з�Ӧ��6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O���ټ��뼸�ε�����Һ������������Na2S2O3��Һ�ζ���������Ӧ��I2+2S2O32-=2I-+S4O62-�� ��������Na2S2O3��Һ��ƽ�����Ϊ20.00mL�������궨�����������Һ��Ũ��Ϊ_______mol/L��
���𰸡� ������ƿ CD S2O32-+2H+��S��+SO2��+H2O ���ȹ��� �Ҵ� �¶ȹ��ᵼ�������ľ���ֽ� 0.2000
������������(1)���������Ĺ����֪������2������Ϊ������ƿ������ʵ������SO2���ɣ���SO2�Ǵ�����Ⱦ����������ŷţ���Ҫβ��������װ��6������������SO2����ֹ��Ⱦ������SO2������������Ҿ��л�ԭ�ԣ����Կ������Ը��������Һ������������Һ���գ�ѡCD���ʴ�Ϊ��������ƿ��CD��
(2)��Ϊ�����������£�������������绯��Ӧ����SO2��S��ˮ����Ӧ�����ӷ���ʽ��S2O32-+2H+=S��+SO2��+H2O��������ҺpHҪ���Ʋ�С��7���ʴ�Ϊ��S2O32-+2H+=S��+SO2��+H2O��
����(1)������������Ƶ��ܽ�����¶ȵ����߶����ͣ����Բ���IӦ���dz��ȹ��ˣ�Na2S2O3������ˮ���������Ҵ�������Ϊ��ֹϴ����ʧ��������ƣ�Ӧ�����Ҵ���ϴ�Ӽ����ʴ�Ϊ�����ȹ��ˣ��Ҵ���
(2)����Na2S2O35H2O��40��45���ۻ���48��ֽ⣬��������ʱҪ�����¶Ȳ��˹��ߵ�ԭ�����¶ȹ��ᵼ�������ľ���ֽ⣬�ʴ�Ϊ���¶ȹ��ᵼ�������ľ���ֽ⣻
(3)���ݷ�Ӧ�ķ���ʽ��֪��
K2Cr2O7��3I2��6 Na2S2O3
1mol 6mol
![]() ��
��![]() mol c��0.02000L
mol c��0.02000L
![]() =
=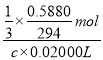 �����c=0.2000mol/L���ʴ�Ϊ��0.2000��
�����c=0.2000mol/L���ʴ�Ϊ��0.2000��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ������ ��
A. ��ѧ��صķ�Ӧ������������ԭ��Ӧ
B. ȼ�ϵ����һ�ָ�Ч���Ի�����ȾС�����͵��
C. ����ӵ�غͼ���п�̸ɵ�ض��Ƕ��ε��
D. Ǧ���طŵ�ʱ������Pb������PbO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ��
A. ������1.0L 0.1mol��L-1 NH4Cl��Һ�У�NH4+��H+��������0.1NA
B. 88.0g�ɱ��к��еĵ��Ӷ���Ϊ8.0NA
C. ��״���£�2.24LCHCl3����ԭ�ӵ���ĿΪ0.5NA
D. ij�¶��£�pH=6�Ĵ�ˮ�к���1.0��10-6NA��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��ƺ�þ��˵���У�����ȷ���ǣ� ��
A. �������NaCl���Եõ�������
B. �������ڸ������ܽ�TiCl4�е����û�����
C. ����þ�Ż𣬿��õ������
D. ����þȼ�պ�ᷢ��ҫ�۵İ⣬��˳����������źŵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ��������������������ϵͳ��������ҵ�ϳɸ�ҩ���м���(F)��·������:

��֪��
�ش��������⣺
��1��D�����еĺ�������������Ϊ_________��_______________��B��C����������Ӧ����Ӧ���ͷֱ�Ϊ_______��______________��
��2��A�Ľṹ��ʽΪ______________________��
��3��д������ȩ��������Һ��Ӧ�Ļ�ѧ����ʽ________________________________��
��4��B��һ��ͬ���칹��������������������ʹ���CCl4��Һ��ɫ��������FeCl3��Һ������ɫ��Ӧ���۷�������4�ֲ�ͬ��ѧ�������⡣д����ͬ���칹��Ľṹ��ʽ_______________������дһ�֣�
��5����֪૱�����![]() CH=CHCON(CH3)2����һ�ָ�Ч��������д����
CH=CHCON(CH3)2����һ�ָ�Ч��������д����![]() ��CH3CHO��NH(CH3)2Ϊԭ���Ʊ�૱����ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�_____________
��CH3CHO��NH(CH3)2Ϊԭ���Ʊ�૱����ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�_____________
H2C=CH2![]() CHCH2Br
CHCH2Br![]() CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�У����ж����ЧӦ����
A.ϡ����B.�������ҺC.�ƾ���ҺD.Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��ƹ����У������ǿ�ͨ��ˮ�ⷴӦ���ɾƾ�
B. ��������Һ�м��뱥����������Һ�����ɵij����ﲻ�����ܽ�
C. ��֬������ʹ���Ը��������ɫ
D. ֬���ܷ���������Ӧ�����ɸ��ͺ�֬������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL����BaCl2��KCl��Һ�Ļ����Һ�ֳ����ȷݣ�ȡһ�ݼ��뺬amol Na2SO4����Һ��ǡ��ʹ��������ȫ��������ȡһ�ݼ��뺬bmol����������Һ��ǡ��ʹ��������ȫ��������û����Һ�м����ӵ�Ũ��Ϊ�� ��
A.0.5��b��2a��mol/L
B.5��b��2a��mol/L
C.0.5��b��a��mol/L
D.10��b��2a��mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
��1����֪��4CO(g)��2NO2(g) ![]() 4CO2(g)��N2(g)����H����1 200 kJ��mol��1
4CO2(g)��N2(g)����H����1 200 kJ��mol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��


��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H��0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K��1.0��
CO2(g)��H2(g)����H��0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K��1.0��
��ʼ���ʵ��� | �� | �� | �� |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
��ƽ��ʱ����������CO��ת������____________���Ƚ�����������CO��ת���ʣ���________�ף���________��(����>��������������<��)��
�ڱ������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת�����������¶�____________(��������������������)��ƽ�ⳣ��K__________(����������������С������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com