
【题目】反应H2(g)+I2(g)![]() 2HI(g)为放热反应,若在恒容绝热的容器中发生,下列选项表明已达平衡状态的是( )
2HI(g)为放热反应,若在恒容绝热的容器中发生,下列选项表明已达平衡状态的是( )
A.气体的总物质的量不再变化
B.容器内的压强不再变化
C.相同时间内,断开H-H键的数目和生成H—I键的数目相等
D.容器内气体的浓度c(H2):c(I2):c(HI)=1:1:2
【答案】B
【解析】
可逆反应,若正反应速率等于逆反应速率,或各物质的浓度、物质的量分数等保持不变,则表明反应一定已达平衡状态,据此分析作答。
A.根据反应可知,该反应前后气体的总物质的量始终不发生改变,因此气体的总物质的量不再变化不能说明反应达到平衡,A不符合题意;
B.在恒容绝热的容器中,容器内的压强为变量,当容器内的压强不再发生改变时,反应达到平衡,B符合题意;
C.相同时间内,断开H—H键的数目和生成H—I键的数目相等,表示的都是正反应,不能判断反应是否达到平衡,C不符合题意;
D.容器内气体的浓度c(H2):c(I2):c(HI)=1:1:2,无法判断各组分的浓度是否发生变化,无法说明反应达到平衡状态,D不符合题意;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
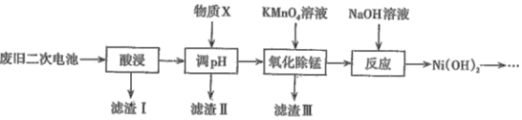
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状态下,两种气态烷烃混合物的密度是1.16g·L-1,该混合物中两种气态烷烃的体积比不可能的是( )
A.2∶5B.1∶5C.9∶5D.16∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将25℃时浓度均为0.1mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图所示。下列说法错误的是( )
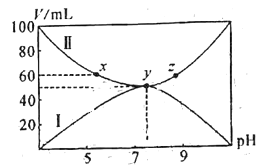
A.曲线II表示HA溶液的体积
B.x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C.电离平衡常数:K(HA)>K(BOH)
D.x、y、z三点对应的溶液中,y点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2·HCHO·2H2O)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产吊白块及氧化锌的工艺流程如图:
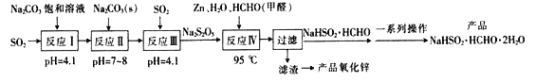
已知:吊白块呈白色块状固体成结晶性粉状,易溶于水,微溶于乙醇,常温时较为稳定,高温下下具有强还原性:120℃以上会分解产生甲醛、二氧化硫和硫化氢等有毒气体。
回答下列问题:
(1)“反应Ⅰ”发生后溶液的pH=4.1,则反应I的产物是__。
(2)设计反应Ⅱ后向反应Ⅲ中继续通入SO2的目的是得到NaHSO3过饱和溶液,从而生成Na2S2O5,则反应Ⅲ中发生反应的化学方程式为__。
(3)“反应Ⅳ”加热的方式最好选用__(填“直接加热”或“水浴加热”);其反应的化学方程式为__。
(4)“过滤”得到的滤液蒸发浓缩时不能在敞口容器中进行,原因是__;洗涤时中的洗涤剂最好选择__(填字母序号)。
A.水 B.无水乙醇 C.稀氢氧化钠溶液
(5)由“滤渣”制备氧化锌的方法是__。
(6)一种测定吊白块中硫的质量分数的方法如下:称取ag产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为bg。则产品中硫的质量分数为__(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:
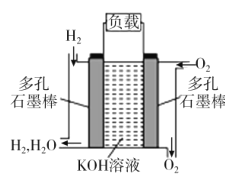
(1)写出氢氧燃料电池工作时的正极反应式:___。
(2)该氢氧燃料电池每转移0.1mo1电子,消耗标准状态下___L氧气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
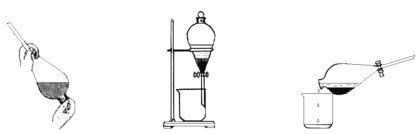
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
①该同学所采用的萃取剂可能是______(填“A”、“B”或“C”)。
A.酒精 B.苯 C.四氯化碳
②甲、乙、丙3步实验操作中,不正确的是______(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:
A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com