
【题目】下列常用的实验仪器中,不能直接用于混合物分离或提纯的是( )
A.分液漏斗
B.普通漏斗
C.蒸馏烧瓶
D.容量瓶
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】(8分)计算:
(1)2mol Na2CO3的质量是 g。
(2)标准状况下11.2 L N2所含分子数是 个。
(3)将80gNaOH溶于水形成1L溶液,所得溶液中NaOH的物质的量浓度 mol/L。
(4)现有100 ml 1.00 mol/L NaCl溶液,所含NaCl固体的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是( )
A.2HClO=2HCl+O2↑
B.Zn+CuSO4=Cu+ZnSO4
C.AlCl3+4NaOH=3NaCl+NaAlO2+2H2O
D.H2+F2=2HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
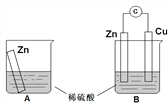
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某些弱酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是________(填编号)。
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是________。
A.c(H+) B. ![]()
C.c(H+)·c(OH-) D. ![]()
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是______________________________。
稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_____________________________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com