
【题目】25℃时,某些弱酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是________(填编号)。
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是________。
A.c(H+) B. ![]()
C.c(H+)·c(OH-) D. ![]()
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是______________________________。
稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_____________________________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
【答案】(1)a>b>d>c (2)A
(3)大于 稀释相同倍数,HX溶液的pH变化比CH3COOH溶液的大,说明HX的酸性强,则其电离平衡常数大 大于 HX酸性强于CH3COOH,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以对水的电离的抑制能力减弱
(4)9.9×10-7mol·L-1
【解析】(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>HCO![]() ,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a>b>d>c。(2)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+浓度都是减小的,OH-浓度是增大的,且CH3COOH浓度减少最多,因此A项正确。(3)稀释相同倍数,HX溶液的pH变化比CH3COOH溶液的大,说明HX的酸性强,则其电离平衡常数大;HX酸性强于CH3COOH,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以对水的电离的抑制能力减弱。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol·L-1-10-8mol·L-1=9.9×10-7mol·L-1。
,而这些酸失去氢离子后水解能力却正好相反,所以得出pH大小顺序为a>b>d>c。(2)醋酸是弱电解质,稀释后电离程度增大,但CH3COOH、CH3COO-、H+浓度都是减小的,OH-浓度是增大的,且CH3COOH浓度减少最多,因此A项正确。(3)稀释相同倍数,HX溶液的pH变化比CH3COOH溶液的大,说明HX的酸性强,则其电离平衡常数大;HX酸性强于CH3COOH,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以对水的电离的抑制能力减弱。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol·L-1-10-8mol·L-1=9.9×10-7mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下对核外电子运动状况的描述正确的是( )
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,收集一试管甲烷和氯气的混合气体,照后观察到量筒内形成一段水柱,认为有氯化氢生成。
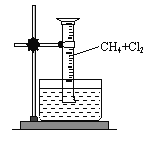
(1)该反应的反应类型为
(2)该反应的化学方程式为(只写第一步) ;
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)你认为该实验设计得出的结论是否正确的 ,
若不正确,理由是:
【实验三】
步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。
(1)SO2和O2反应制取SO3的反应原理为2SO2(g)+O2(g) ![]() 2SO3(g),在一密闭容器中一定时间内达到平衡。
2SO3(g),在一密闭容器中一定时间内达到平衡。
①该反应的平衡常数表达式为K=________。
②该反应达到平衡状态的标志是________。
A.v(SO2)=v(SO3)
B.混合物的平均相对分子质量不变
C.混合气体质量不变
D.各组分的体积分数不变
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

① B电极的电极反应式_______________________________________。
②溶液中H+的移动方向由________极到________极(用A、B表示);
(3)测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。
________Fe2++________MnO![]() +________===________Fe3++________Mn2++________
+________===________Fe3++________Mn2++________
② 用硫酸酸化的KMnO4滴定终点的标志是
___________________________________
___________________________________。
③计算上述产品中FeSO4·7H2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要氧化物,具有特殊的性质。下面是某化学学习小组对二氧化硫性质的验证实验。
(1)实验用品:分液漏斗、__________(玻璃仪器名称)、试管、具支试管、玻璃导管、乳胶管;亚硫酸钠晶体、硫酸(75%~90%)、NaOH稀溶液、NaOH浓溶液、酸性KMnO4溶液、Na2S稀溶液、酚酞试剂。
(2)实验装置

装置图中分液漏斗内的试剂是_________________________。
(3)实验步骤
①按照图示装置连接好实验仪器,检查装置气密性。检查方法是_____________________。
②在具支试管Ⅱ、Ⅲ、Ⅳ中分别加入2 mL NaOH稀溶液(溶液中滴有酚酞试剂)、2 mL酸性KMnO4溶液、2 mL Na2S稀溶液。其中Ⅱ中的实验现象是_____________________________;
Ⅲ中现象说明SO2具有__________性;Ⅳ中若持续通入SO2,写出发生反应的化学方程式:__________________________________。
(4)如果将具支试管Ⅲ内的酸性KMnO4溶液换为氯水,那么具支试管Ⅲ中发生反应的现象是_______________________,发生反应的离子方程式是_________________________。
(5)试管Ⅴ中加入的是NaOH浓溶液,其作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.CaCl2=Ca2++Cl2
B.Na2SO4=Na++SO42﹣
C.HNO3=H++NO3﹣
D.KOH=K++O2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属首饰可能含有铜或银,欲检验其是否用纯金制成,可把样品浸入某溶液一段时间后,取出洗净、干燥后称量,根据质量是否变化即可判断.可以选用的溶液是( )
A.稀硫酸
B.盐酸溶液
C.稀硝酸
D.氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com