
【题目】铅蓄电池的两极分别为铅和二氧化铅,电解质溶液为硫酸,工作时的电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列结论正确的是( )
A.铅为正极被氧化
B.溶液的pH不断减小
C.硫酸根离子只向二氧化铅处移动
D.电子由铅极流向二氧化铅极
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属钠应保存在水里以隔绝空气
B.常温下铁能与水蒸气反应生成氢气
C.可以用铁制品或铝制品容器盛放浓H2SO4
D.铝较活泼,所以铝制品在空气中不能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
(查阅资料)碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
(碘的制取)以海带为原料,按照以下步骤进行实验。

(1)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为________。
(2)步骤C中使用的起到分离作用的仪器是_______,使用该仪器时,第一步操作是_______________。
(3)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
(4)(碘的分离)得到含I2的CCl4溶液后,利用下图装置进行碘的提取并回收溶剂。

图中有两处明显错误,分别是①_________;②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列污水处理的方法中,表示其原理的离子方程式不正确的是
A.混凝法,用明矾做混凝剂:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
B.中和法,用过量CO2中和碱性废水:CO2+2OH—=CO32—
C.沉淀法,用Na2S处理含Hg2+废水:Hg2++S2—=HgS↓
D.氧化还原法,用FeSO4将酸性废水中Cr2O72—还原为Cr3+:Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气的排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g) △H1= a kJ·mol-1
2NO(g) △H1= a kJ·mol-1
②CO(g)+1/2 O2(g)![]() CO2(g) △H2= b kJ·mol-1
CO2(g) △H2= b kJ·mol-1
③2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H3
N2(g)+2CO2(g) △H3
请回答下列问题:
(1)△H3=_________kJ·mol-1(用含a、b的代数式表示)。
(2)对于有气体参与的反应,则反应①的平衡常数表达式K=___________。
(3)能说明反应③已达平衡状态的标志是________(填字母)。
A.单位时间内生成1mol CO2的同时消耗了lmol CO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)在一定温度下,向体积为VL的恒容密闭容器中充入一定量的NO和CO,发生反应③。在t1时刻达到平衡,此时n(CO)=xmol,n(NO)=2xmol,n(N2)=ymol,则NO的平衡转化率为____________(用含x、y的代数式表示);t2时刻再向容器中充入ymolCO2,则此时v(正)_________(填“>”、“<”或“=”)v(逆)。
(5)烟气中也含有氮氧化物,C2H4可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如右图所示。为达到最高的NO去除率,应选择的反应温度约为______,Cu2+负载量为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
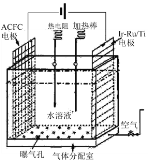
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
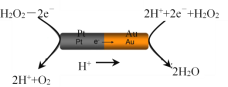
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素![]() 在表中的位置,按要求回答下列问题:
在表中的位置,按要求回答下列问题:
周期主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ⅧA |
一 |
| |||||||
二 |
|
|
| |||||
三 |
|
|
|
|
|
(1)在元素![]() ,最活泼的金属元素是______
,最活泼的金属元素是______![]() 填元素名称
填元素名称![]() ;最活泼的非金属元素名称是______
;最活泼的非金属元素名称是______![]() 填元素名称
填元素名称![]()
(2)用电子式表示元素![]() 与
与![]() 形成的原子个数比为1:2的化合物 _______________。元素①和③所形成的化学键的类型是___________________。
形成的原子个数比为1:2的化合物 _______________。元素①和③所形成的化学键的类型是___________________。
(3)![]() 、
、![]() 三种元素的原子半径由大到小的顺序是______
三种元素的原子半径由大到小的顺序是______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)元素![]() 和
和![]() 所能形成的气态氢化物的稳定性___________
所能形成的气态氢化物的稳定性___________![]() 化学式表示
化学式表示![]() ;元素
;元素![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物的酸性由强到弱的顺序 ___
的最高价氧化物对应的水化物的酸性由强到弱的顺序 ___![]() 化学式表示
化学式表示![]()
(5)写出元素![]() 和
和![]() 的最高价氧化物的水化物相互反应的离子方程式:______________。
的最高价氧化物的水化物相互反应的离子方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com